
科目: 来源:福建省泉州市2018届九年级上学期教学质量检测化学试卷 题型:单选题
下列各组实验方法不可行的是( )
A. 用燃着的木条检验一瓶无色气体是否是二氧化碳
B. 用加热方法除去氯化钾固体中少量的氯酸钾
C. 用水区别氢氧化钠和硝酸铵两种白色固体
D. 用冷却硝酸钾的热饱和溶液得到硝酸钾晶体
A 【解析】A、氮气和二氧化碳等都不具有助燃性,所以燃着的木条熄灭,不能用燃着的木条检验一瓶无色气体是否是二氧化碳,而应该用澄清石灰水鉴别,错误;B、氯酸钾在加热的条件下生成氯化钾和氧气,可以用加热方法除去氯化钾固体中少量的氯酸钾,正确;C、氢氧化钠溶于水,溶液温度升高,硝酸铵溶于水,溶液温度降低,现象不同,可以鉴别,正确;D、硝酸钾的溶解度受温度饱和影响较大,所以用冷却硝酸钾的热饱和溶液得...查看答案和解析>>
科目: 来源:福建省泉州市2018届九年级上学期教学质量检测化学试卷 题型:单选题
用15%的葡萄糖溶液配制150g5%的葡萄糖溶液,下列做法不正确的是( )
A. 取用15%的葡萄糖溶液50g
B. 使用量筒、烧杯和漏斗等仪器
C. 加水100g
D. 量水时选用规格100mL的量筒
B 【解析】A、根据溶液稀释前后溶质的质量不变,设取用15%的葡萄糖溶液为x,x×15%=150g×5%,解得x=50g,正确;B、用15%的葡萄糖溶液配制150g 5%葡萄糖溶液,首先计算配制溶液所需15%的葡萄糖溶液和水的质量,再量取所需的葡萄糖溶液体积和量取水的体积,最后进行溶解;在这些操作中需要的仪器:量筒、胶头滴管、烧杯和玻璃棒,错误;C、溶质质量=溶液质量×溶质的质量分数,配制1...查看答案和解析>>
科目: 来源:福建省泉州市2018届九年级上学期教学质量检测化学试卷 题型:单选题
下列所示的四个图像,不能正确反映对应关系变化的是( )

A. A B. B C. C D. D
D 【解析】A、红磷燃烧,放热,气体膨胀,开始上升,消耗氧气,气压减少,直到反应停止,正确;B、加热一定量的高锰酸钾固体时,高锰酸钾分解生成锰酸钾、二氧化锰和氧气,随着反应的进行,固体中锰元素质量不变,正确;C、电解水生成氢气和氧气的体积比是2:1,正确;D、饱和NaCl溶液恒温蒸发水时,仍然是饱和溶液,由于温度不变,氯化钠的溶解度不变,因此氯化钠的质量分数不变,错误。故选D。查看答案和解析>>
科目: 来源:福建省泉州市2018届九年级上学期教学质量检测化学试卷 题型:填空题
人类对材料的发现和使用经历了从石器、青铜器、铁器到铝的大规模使用等漫长的征程。
(1)青铜的硬度比纯铜________(填“大”或“小”)。
(2)工业上炼铁的反应原理:炼铁高炉内生成的______(写物质化学式)在高温条件下与氧化铁反应生成铁。
(3)铝活动性比铁强,但在空气中铝制品比铁制品更耐腐蚀,原因是______________。
(4)日常生活中防止铁生锈的方法有__________(写一种)。
大 CO 铝与氧气反应形成致密的氧化铝膜覆盖在铝的表面 涂防锈油 【解析】(1)由于合金的硬度大于纯金属的硬度,所以工业上用青铜制造轴承、齿轮,而不用纯铜,其原因之一是青铜的硬度比纯铜的硬度大; (2)工业炼铁的原理是在高温的条件下,用一氧化碳还原氧化铁生成铁; (3)铝比铁活泼,但是铝制品比铁制品耐腐蚀,原因是:铝在常温下与空气中的氧气发生化学反应,使铝的表面生成了一层致密的氧...查看答案和解析>>
科目: 来源:福建省泉州市2018届九年级上学期教学质量检测化学试卷 题型:填空题
空气的主要成分是氧气和氮气。
(1)空气属于________(填“混合物”或“纯净物”)。
(2)用“?”表示氮原子,“●”表示氧原子。
①用“ ”可表示的微粒是______(填名称)。
”可表示的微粒是______(填名称)。
②同温同压下,气体的体积比等于分子数目比。若空气中其它成分忽略不计,如图可表示空气微观模型的是____(填标号)。

(3)下图是氧元素在元素周期表中的信息及微粒结构示意图。

①从图1中可获得多条信息,其一是__________。
②若图2中表示氧原子,在化学反应中,氧原子容易______(填“得”或“失”)电子。
③若图2中,x=8时,该微粒是_________(写微粒符号)。
(4)以下是利用空气制取氮肥过程中重要的一步化学反应微观示意图。

①该反应的化学方程式是________。
②物质所含元素化合价发生变化的反应属于氧化还原反应。该反应_______(填“属于”或“不属于”)氧化还原反应。
混合物 氮分子 C 氧的相对原子质量为16.00 得 O2- 4NH3+5O24NO+6H2O 属于 【解析】(1)空气中含有氧气、氮气、二氧化碳等物质,属于混合物; (2)①分子是由原子构成的,用“”可表示的微粒是氮分子; ②同温同压下,气体的体积比等于分子数目比。氧气约占空气体积的1/5,若空气中其它成分忽略不计,微观上氮分子与氧分子的个数比为4:1,图中可表示空气微观模型的...查看答案和解析>>
科目: 来源:福建省泉州市2018届九年级上学期教学质量检测化学试卷 题型:填空题
水和水溶液是人类必不可少的物质。
(1)科学家对水的生成和分解实验的研究,确认了水是由______和______组成的。
(2)自然界中的水都不是纯水,利用沉淀、_______、吸附和蒸馏等方法可以净化水。
(3)生活中简便区别硬水和软水的方法是_______________。
(4)下图为甲乙两物质的溶解度曲线。
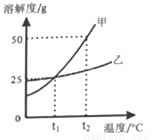
①t2℃时,溶解度较大的物质是_________。
②t1℃时,乙物质饱和溶液中溶质的质量分数为________。
③t2℃时,将50g甲物质放入50g水中,充分溶解后,发现有未溶解的甲物质,其质量是______g。
(1)水能灭火,但有时水也能“生火”。比如将过氧化钠(Na2O2)用脱脂棉包裹,再向上面滴加水,脱脂棉一会儿就会发生燃烧。该反应的化学方程式为:2Na2O2+2H2O═4NaOH+X↑。
①X的化学式是______。
②包裹过氧化钠的脱脂棉滴水后,引起脱脂棉能燃烧起来的原因是________。
氢元素(或H) 氧元素(或O) 过滤 分别取样,加入肥皂水,搅拌,产生泡沫很少且有白色垢状物形成的水为硬水 甲 20% 25 O2 过氧化钠与水反应放出热量,使脱脂棉的温度达到着火点且产生大量氧气 【解析】(1)物质是由元素组成的,是由科学家对水的生成和分解实验的研究,确认了水是由氢元素和氧元素组成的; (2)自然界中的水都不是纯水,利用沉淀、过滤、吸附和蒸馏等方法可以净化水; ...查看答案和解析>>
科目: 来源:福建省泉州市2018届九年级上学期教学质量检测化学试卷 题型:推断题
甲、乙是初中化学常见的物质,它们与氧气之间存在如下图所示的反应关系(“—”表示物质间相互反应,“→”表示物质间转化,部分反应物、生成物及反应条件略去)。
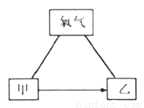
(1)若甲是一种黑色的固态非金属单质,乙是一种氧化物。
①甲的化学式为______。②乙与氧气反应的基本类型是_________。
(2)若甲、乙均为金属单质,且乙呈紫红色。
①乙在生活中的一种用途是________。
②“甲→乙”的化学方程式为_______________。
③用稀硫酸代替氧气,上图所示反应关系不能成立,原因是____________。
C 化合反应 作导线 Fe+CuSO4=FeSO4+Cu 乙不能与硫酸(稀)发生反应 【解析】根据甲、乙是初中化学常见的物质,根据“甲是一种黑色的固态非金属单质,乙是一种氧化物”,初中常见的黑色物质有石墨、四氧化三铁、二氧化锰、铁粉、氧化铜。由此可知甲可能为碳、乙为一氧化碳;根据“若甲、乙均为金属单质,且乙呈紫红色”,则推测乙为铜,甲为比铜活泼的金属,例如铁,代入检验正确。(1)若甲是一种黑...查看答案和解析>>
科目: 来源:福建省泉州市2018届九年级上学期教学质量检测化学试卷 题型:综合题
实验室利用下图所示装置进行相关实验,请回答问题。

(1)写出图中标号仪器的名称:a__________,b___________。
(2)用双氧水和二氧化锰制取氧气,反应的化学方程式为_______________,应选用发生装置是______(填标号);该反应中转化为氧气的氧元素的质量,占参加反应的过氧化氢中氧元素质量的质量分数是___________。
(3)二氧化碳也可用碳酸氢钠(NaHCO3)固体加热分解(产物为碳酸钠、二氧化碳和水)来制取,该反应的化学方程式为___________;若用此法来制取二氧化碳,应选用的发生装置是______(填标号,下同),收集装置是________。
试管 分液漏斗 2H2O22H2O+O2↑ B 50% 2NaHCO3 Na2CO3+H2O+CO2↑ A E 【解析】(1)仪器a是试管,仪器b是分液漏斗; (2)如果用双氧水和二氧化锰制氧气就不需要加热,过氧化氢在二氧化锰做催化剂的条件下生成水和氧气,化学方程式为2H2O22H2O+O2↑;2个过氧化氢分子中有4个氧原子,其中2个氧原子转化为氧气分子,因此该反应中转化为氧气的氧元素...查看答案和解析>>
科目: 来源:福建省泉州市2018届九年级上学期教学质量检测化学试卷 题型:科学探究题
镁条放置在空气中一段时间表面会形成一层黑色物质,为探究镁表面黑色物质的生成是与空气中的哪些成分有关,开展以下实验探究。
化学小组查得以下资料:
Ⅰ.常温下,空气中的氮气和稀有气体不会与镁发生反应。
Ⅱ.无水CaCl2固体有较强的吸水性,能吸收空气中的水蒸气。
[实验1]按图1所示装置进行实验,数日后,只观察到镁条表面变暗,没有出现黑色物质。

(1)查阅文献获知,镁条表面变暗是镁与氧气反应的结果,该反应的化学方程式为________。
(2)据此现象,可说明就______和_______两种物质无法使镁生成黑色物质。
[实验2]按图2所示装置进行实验,数日后,只观察到镁条表面变暗,没有出现黑色物质。

(3)该实验的目的是________。
[实验3]按图3所示装置进行实验,数日后,观察到镁条表面出现黑色物质。

(4)得出“镁条变黑一定与水有关”的结论,依据的两个实验是_________(填实验序号)。
[实验4]化学小组认为据此现象还不足以得出最终结论,于是又补做了如下实验:
(5)将图3中潮湿的空气换成_________进行实验,数日后,观察到镁条表面无明显变化。
(6)根据上述四个实验,化学小组得出结论:镁表面的黑色物质是镁与_________等物质共同作用的结果。
2Mg+O2=2MgO氧气(或O2)水(或H2O)验证氧气和二氧化碳,能否时镁生成黑色物质实验2和实验3潮湿的二氧化碳氧气(或O2)、二氧化碳(或CO2)和水(或H2O) 【解析】 (1)查阅文献获知,镁条表面变暗是镁与氧气反应生成氧化镁,配平即可,化学方程式为:2Mg+O2=2MgO; (2)潮湿的氧气中含有氧气和水蒸气,据此现象,可说明就氧气和水两种物质无法使镁生成黑色物质;...查看答案和解析>>
科目: 来源:福建省泉州市2018届九年级上学期教学质量检测化学试卷 题型:计算题
化学兴趣小组为测定一批石灰石样品中碳酸钙的质量分数,取用20 g石灰石样品,进行高温煅烧(样品除碳酸钙外,其余成分高温不分解。碳酸钙高温分解的化学方程式为CaCO3
 CaO+CO2↑),测得石灰石煅烧过程中的不同时段剩余固体质量如下表所示:
CaO+CO2↑),测得石灰石煅烧过程中的不同时段剩余固体质量如下表所示:
煅烧的时间(min) | 剩余固体的质量(g) |
2 | 17.8 |
4 | 13.4 |
6 | 12.3 |
8 | 12.3 |
(1)完全反应后生成二氧化碳的质量______g。
(2)求石灰石样品中碳酸钙的质量分数______。
7.7g 87.5% 【解析】 (1)根据质量守恒定律可知,碳酸钙分解放出气体二氧化碳的质量=20g-12.3g=7.7g; (2)【解析】 设石灰石中碳酸钙的质量为x. CaCO3 CaO+CO2↑ 100 44 x 7.7g x=17.5g 碳酸钙的质量分数=×100%=87.5% 答:石灰石中碳酸钙的质量分数为87.5%。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com