
科目: 来源:2018年秋沪教版九年级化学全册同步练习:5.1.1金属的性质 题型:单选题
化学是一门以实验为基础的科学。下列有关实验现象的描述中正确的是( )
A. 铁丝在空气中剧烈燃烧,发出耀眼的白光
B. 在空气中加热铜丝,可以观察到其表面变黑
C. 将镁条放入稀盐酸中,观察到固体逐渐溶解,产生大量氢气
D. 将铁钉放入硫酸铜溶液中,观察到固体全部溶解,得到浅绿色溶液
B 【解析】 A、铁丝在空气中不能燃烧,故选项错误;B、在空气中加热铜片,铜片表面有黑色固体生成,故选项正确;C、镁条放入稀盐酸中,固体逐渐溶解,表面会迅速产生大量气泡,故选项错误;D、铁和硫酸铜反应生成硫酸亚铁和铜,硫酸亚铁溶液呈浅绿色,铜是红色固体,铁钉表面附着一层红色物质,故选项错误。故选B。查看答案和解析>>
科目: 来源:2018年秋沪教版九年级化学全册同步练习:5.1.1金属的性质 题型:单选题
镁是一种化学性质活泼的金属,在空气中常温下就能被缓慢氧化。下列有关镁条燃烧实验的说法不正确的是( )
A. 实验前,应先用砂纸打磨镁条至表面出现银白色
B. 实验时,应使用石棉网
C. 实验时,应用坩埚钳夹持镁条,在酒精灯上点燃
D. 镁条在空气中缓慢燃烧,发出耀眼的黄光,有大量黑烟生成
D 【解析】 A、镁是一种化学性质活泼的金属,在空气中常温下就能被缓慢氧化,因此用砂纸打磨镁条的目的是除去表面的氧化膜,便于镁条的燃烧,故A正确;B、镁条燃烧放出大量的热,生成物的温度较高掉落下来容易灼烧桌面,因此可以用石棉网承接,故B正确;C、燃烧镁条会放出大量的热,因此可以用坩埚钳夹持进行燃烧,故C正确;D、镁条燃烧会发出耀眼的强光,放出大量的热,生成白色固体,故D错误。故选D。 ...查看答案和解析>>
科目: 来源:2018年秋沪教版九年级化学全册同步练习:5.1.1金属的性质 题型:填空题
我国是现代湿法冶金术的先驱,早在西汉时期,刘安在《淮南万毕术》中写到“曾青得铁则化为铜”。这里的“曾青”是指____________________(如硫酸铜)。在宋朝,利用这个反应冶铜的生产具有了一定的规模,该反应的化学方程式为______________________。
可溶性的铜的化合物Fe+CuSO4=FeSO4+Cu 【解析】 “曾青得铁则化为铜”,这里的曾青是指硫酸铜一类的化合物,意思是说,铁能与硫酸铜溶液反应生成硫酸亚铁和铜,反应的化学方程式为Fe+CuSO4═FeSO4+Cu。查看答案和解析>>
科目: 来源:2018年秋沪教版九年级化学全册同步练习:5.1.1金属的性质 题型:单选题
下列反应属于置换反应的是( )
A. C+O2 CO2 B. CaCO3
CO2 B. CaCO3 CaO+CO2↑
CaO+CO2↑
C. NaOH+HCl=NaCl+H2O D. 2Al+Fe2O3 Al2O3+2Fe
Al2O3+2Fe
查看答案和解析>>
科目: 来源:2018年秋沪教版九年级化学全册同步练习:5.1.1金属的性质 题型:实验题
实验室部分仪器或装置如图所示。请回答下列问题。

资料:①浓硫酸具有吸水性,可作一些气体的干燥剂。
②实验室可以用锌粒和稀硫酸在常温下制取氢气。
(1)写出图中仪器a的名称:___________________________________________________。
(2)在实验室里用一种固体和一种液体混合,不加热,制取并收集一瓶干燥的气体,请选择上述仪器,按照产生气体的流向从左到右的顺序,连接成一套实验装置(填大写字母标号):____接____接____接______接______。
(3)若制备氢气,收集、燃烧氢气之前需要________,除了图中出现的收集方法外,氢气还可以用_____法收集,这是因为___________________________________________。
(4)实验中,连接玻璃管和胶皮管的方法是_____________________________________。
长颈漏斗FACBE验纯排水氢气难溶于水先把玻璃管口用水润湿,然后稍用力把玻璃管旋转插入胶皮管 【解析】 (1)a是长颈漏斗; (2)该气体是固液反应气体的发生装置,需要A和F装置;浓硫酸具有吸水性,可以做干燥剂;收集气体需要导气管和集气瓶,故连接的顺序是:F→A→C→B→E; (3)氢气具有可燃性,点燃不纯的氢气可能会发生爆炸,故点燃氢气之前必须检验氢气的纯度;图中用向上排...查看答案和解析>>
科目: 来源:2018年秋沪教版九年级化学全册同步练习:5.1.1金属的性质 题型:单选题
现有甲、乙、丙三种金属,分别与空气和氧气反应,现象如下表所示:
甲 | 乙 | 丙 | |
空气 | 剧烈燃烧 | 变黑 | 变黑 |
氧气 | 更剧烈燃烧 | 变黑 | 剧烈燃烧 |
据以上信息,这三种金属的活动性由强到弱的顺序是( )
A. 甲>丙>乙 B. 甲>乙>丙 C. 乙>丙>甲 D. 丙>乙>甲
A 【解析】 根据信息可知与同一物质反应时现象越剧烈其活动性越强,由甲、乙、丙三者与空气的反应可以知道甲与空气反应最剧烈,其活动性最强,由甲、乙、丙三者与氧气反应的现象丙剧烈燃烧乙仍然是变黑,丙的反应比乙更剧烈一些,所以丙的活动性比乙强,综合结论可知三者的活动性由强到弱的顺序是:甲、丙、乙。故选A。查看答案和解析>>
科目: 来源:2018年秋沪教版九年级化学全册同步练习:5.1.1金属的性质 题型:单选题
下列现象和事实,可用金属活动性作出合理解释的是( )
①相同几何外形的金属镁、铝分别与相同浓度的稀盐酸反应,镁反应更剧烈,说明镁比铝的金属活动性强
②用硫酸铜、石灰水配制农药波尔多液时,不能用铁制容器盛放
③尽管金属的种类很多,但在自然界中,仅有少数金属(银、铂、金)以单质形式存在
④金属铝比金属锌更耐腐蚀,说明锌比铝的金属活动性强
A. ①②③ B. ①② C. ③④ D. ①②③④
A 【解析】 ①在金属活动顺序表中,排在氢前边的金属能和酸发生置换反应生成盐和氢气。金属的位置越靠前,金属的活动性越强。相同几何外形的金属镁、铝分别与相同浓度的稀盐酸反应,镁反应更剧烈,说明镁比铝的金属活动性强,正确;②用硫酸铜、石灰水配制农药波尔多液时,不能用铁制容器盛放,因为铁能与硫酸铜反应,使波尔多液的药效降低;③尽管金属的种类很多,但在自然界中,仅有少数金属(银、铂、金)以单质...查看答案和解析>>
科目: 来源:2018年秋沪教版九年级化学全册同步练习:5.1.1金属的性质 题型:填空题
铝在工业和生活中应用广泛。
(1)铝是地壳中含量最高的_________(填“金属”或“非金属”)元素,其年产量已跃居第二位。
(2)铝可制成电线,主要是利用其有良好的延展性和________性。
(3)铝制品具有很好的抗腐蚀性能,其原因是___________________________________。
金属导电在常温下,铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步被氧化 【解析】 (1)铝是地壳中含量最高的金属元素; (2)铝可制成电线,主要是利用其有良好的延展性和导电性; (3)根据铝的化学性质,在常温下,铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步被氧化,从而使铝有较好的抗腐蚀性。查看答案和解析>>
科目: 来源:2018年秋沪教版九年级化学全册同步练习:5.1.1金属的性质 题型:实验题
请按要求完成下列金属性质的实验。
探究一:金属与酸反应过程中的能量变化。
(1)打磨后的镁条与稀盐酸反应,试管外壁发烫,说明该反应________(填“吸热”或“放热”),反应的化学方程式为____________________________________________________。
(2)实验测得反应中产生气体的速率(v)与时间(t)的关系如图,请根据t1~t2时间段反应速率的变化,说明化学反应速率受________等因素影响。
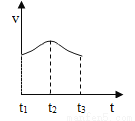
探究二:金属与金属化合物溶液反应过程中的相关变化。
(3)某同学用硫酸铜溶液把“铁勺”变“铜勺”,其反应的化学方程式为______________________。
放热Mg+2HCl=MgCl2+H2↑温度CuSO4+Fe=FeSO4+Cu 【解析】 (1)打磨后的镁条与稀盐酸反应,试管外壁发烫,说明该反应放热,镁与盐酸反应会生成氢气和氯化镁,化学方程式为:Mg+2HCl=MgCl2+H2↑; (2)通过图中的反应速率可以看出,在t1-t2时间段速率加快,所以化学反应速率受温度等因素影响; (3)铁和硫酸铜反应生成硫酸亚铁和铜,化学方...查看答案和解析>>
科目: 来源:2018年秋沪教版九年级化学全册同步练习:5.1.1金属的性质 题型:综合题
某工厂废液中含有CuSO4(其他成分不含铜元素),现按以下流程回收金属铜。

(1)回收过程中,加入适量稀硫酸可除去过量铁屑,该反应的化学方程式为Fe+H2SO4=FeSO4+H2↑,这个反应所属的基本反应类型是______________。
(2)洗涤后的滤渣不能用加热的方法干燥,其原因是______________________________。
(3)现有一批废液,其中含4 t CuSO4,理论上可从该废液中回收得到多少吨金属铜________________?
置换反应加热时,铜要与氧气反应,生成新物质CuO,导致回收到的铜不纯1.6t 【解析】 (1)Fe+H2SO4═FeSO4+H2↑,由一种单质和一种化合物反应,生成另外一种单质和一种化合物的反应,属于置换反应; (2)由于洗涤后的滤渣为金属铜,加热时,铜要与氧气反应,生成氧化铜,导致回收到的铜不纯; (3)设理论上可从该废液中回收得到的金属铜的质量为x, Fe+CuS...查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com