
科目: 来源:北京课改版2019届九年级上册化学 7.2化学方程式 同步练习题 题型:单选题
对于化学反应方程式S+O2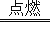 SO2表示的意义,叙述错误的是
SO2表示的意义,叙述错误的是
A. 在点燃的条件下,硫和氧气生成了二氧化硫
B. 硫加氧气反应生成二氧化硫
C. 每32份质量的硫和32份质量的氧气完全反应能生成64份质量的二氧化硫
D. 在点燃的条件下,每一个硫原子和一个氧分子化合生成一个二氧化硫分子
 B
【解析】
A、在点燃的条件下,硫和氧气反应生成了二氧化硫,说法正确,故A正确;
B、硫加氧气反应生成二氧化硫,说法错误,因为读法错误,故B错误;
C、每32份质量的硫和32份质量的氧气完全反应能生成64份质量的二氧化硫,说法正确,故C正确;
D、在点燃的条件下,每一个硫原子和一个氧分子化合生成一个二氧化硫分子,说法正确,故D正确.
B
【解析】
A、在点燃的条件下,硫和氧气反应生成了二氧化硫,说法正确,故A正确;
B、硫加氧气反应生成二氧化硫,说法错误,因为读法错误,故B错误;
C、每32份质量的硫和32份质量的氧气完全反应能生成64份质量的二氧化硫,说法正确,故C正确;
D、在点燃的条件下,每一个硫原子和一个氧分子化合生成一个二氧化硫分子,说法正确,故D正确.查看答案和解析>>
科目: 来源:北京课改版2019届九年级上册化学 7.2化学方程式 同步练习题 题型:简答题
磷在氧气中燃烧这个反应的化学方程式为________ ,其中P,O2, P2O5之间的质量比是________ .若参加反应的P的质量为12.4g,则生成的P2O5的质量为________ ;若生成的P2O5的质量为142g,则参加反应的氧气的质量为________ .
 4P+5O22P2O5; 124:160:284 28.4g; 80g
【解析】
磷在氧气中燃烧的化学方程式为:
在此反应中磷、氧气和五氧化二磷的质量关系124:160:284=31:40:71.
若参加反应的P的质量为12.4g,设生成P2O5的质量为x,
x=28.4g.
若生成的P2O5的质量为142g,设参加反应的氧气的质量y,
y=80g.
...
4P+5O22P2O5; 124:160:284 28.4g; 80g
【解析】
磷在氧气中燃烧的化学方程式为:
在此反应中磷、氧气和五氧化二磷的质量关系124:160:284=31:40:71.
若参加反应的P的质量为12.4g,设生成P2O5的质量为x,
x=28.4g.
若生成的P2O5的质量为142g,设参加反应的氧气的质量y,
y=80g.
...查看答案和解析>>
科目: 来源:北京课改版2019届九年级上册化学 7.2化学方程式 同步练习题 题型:填空题
配平下列化学方程式:
(1)________Al2O3 ________Al+________O2↑
________Al+________O2↑
(2)________C2H4+________O2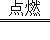 ________CO2+________H2O
________CO2+________H2O
(3)________KClO3 ________KCl+________O2↑
________KCl+________O2↑
(4)________Fe2O3+________CO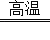 ________Fe+________CO2 .
________Fe+________CO2 .
 2; 4; 3; 1; 3; 2; 2; 2; 2; 3; 1; 3; 2; 3
【解析】
(1)利用最小公倍数法进行配平,以氧原子作为配平的起点,Al2O3、O2前面的化学计量数分别为:2、3,最后调整铝前面的化学计量数为4.
(2)本题可利用“定一法”进行配平,把C2H4的化学计量数定为1,则氧气、二氧化碳、水前面的化学计量数分别为:3、2、2.
(3)利用最小公倍数法...
2; 4; 3; 1; 3; 2; 2; 2; 2; 3; 1; 3; 2; 3
【解析】
(1)利用最小公倍数法进行配平,以氧原子作为配平的起点,Al2O3、O2前面的化学计量数分别为:2、3,最后调整铝前面的化学计量数为4.
(2)本题可利用“定一法”进行配平,把C2H4的化学计量数定为1,则氧气、二氧化碳、水前面的化学计量数分别为:3、2、2.
(3)利用最小公倍数法...查看答案和解析>>
科目: 来源:北京课改版2019届九年级上册化学 7.2化学方程式 同步练习题 题型:填空题
配平和完成下列化学方程式:
(1) P+
P+ FeO
FeO
 P2O5+
P2O5+ Fe _________________
Fe _________________
(2)  Fe(红热)+
Fe(红热)+  H2O(气)——
H2O(气)—— Fe3O4+
Fe3O4+ H2 _________________
H2 _________________
(3)  N2+
N2+ H2——
H2—— NH3 _________________
NH3 _________________
(4)  Al+
Al+ Fe3O4——
Fe3O4—— Fe+
Fe+ Al2O3 _________________
Al2O3 _________________
 2P+5FeOP2O5+5Fe3Fe(红热)+4H2O(g) Fe3O4+4H2↑N2+3H2====2NH32Al+Fe2O32Fe+Al2O3
【解析】
(1)2P+5FeOP2O5+5Fe
(2)3Fe(红热)+4H2OFe3O4+4H2↑
(3) N2+3H2=2NH3
(4) 2Al+Fe2O32Fe+Al2O3
2P+5FeOP2O5+5Fe3Fe(红热)+4H2O(g) Fe3O4+4H2↑N2+3H2====2NH32Al+Fe2O32Fe+Al2O3
【解析】
(1)2P+5FeOP2O5+5Fe
(2)3Fe(红热)+4H2OFe3O4+4H2↑
(3) N2+3H2=2NH3
(4) 2Al+Fe2O32Fe+Al2O3查看答案和解析>>
科目: 来源:北京课改版2019届九年级上册化学 7.2化学方程式 同步练习题 题型:填空题
配平下列化学方程:
(1)________Al+________Fe3O4  ________Al2O3+________Fe
________Al2O3+________Fe
(2)________ NH3+________O2  ________NO+________H2O
________NO+________H2O
(3)________FeS2+________O2  ________Fe2O3+________SO2;
________Fe2O3+________SO2;
(4)________Fe2O3+________HCl=________FeCl3+________H2O.
 8;4;3;94;5;4;64;11;2;81;6;2;3
【解析】
(1)利用最小公倍数法进行配平,以氧原子作为配平的起点,Fe3O4、Al2O3前面的化学计量数分别为:3、4,最后调整铝、铁前面的化学计量数为8、9.(2)本题可利用“定一法”进行配平,把NH3的化学计量数定为1,则O2、NO、H2O前面的化学计量数分别为:、1、,同时扩大4倍,则NH3、O2、NO、H2O前面的化学...
8;4;3;94;5;4;64;11;2;81;6;2;3
【解析】
(1)利用最小公倍数法进行配平,以氧原子作为配平的起点,Fe3O4、Al2O3前面的化学计量数分别为:3、4,最后调整铝、铁前面的化学计量数为8、9.(2)本题可利用“定一法”进行配平,把NH3的化学计量数定为1,则O2、NO、H2O前面的化学计量数分别为:、1、,同时扩大4倍,则NH3、O2、NO、H2O前面的化学...查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com