
科目: 来源:江苏省2018届九年级上学期期末考试化学试卷 题型:流程题
有Mg、Fe、Cu的混合粉末,分离并得到MgSO4·7H2O过程如下:
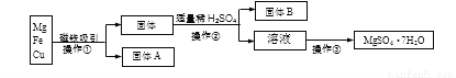
(1)固体A是____________________。
(2)操作②中用到的主要玻璃仪器有________________、玻璃棒和烧杯等。
(3)操作③主要包含蒸发浓缩、______________、过滤、洗涤烘干等。
(4)实验中可选用适量的下列试剂中的________________代替稀H2SO4(填标号)。
a.CuSO4溶液 b.FeSO4溶液 c.稀盐酸
查看答案和解析>>
科目: 来源:江苏省2018届九年级上学期期末考试化学试卷 题型:填空题
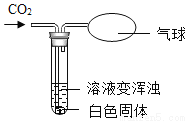
过氧化钙[CaO2]能溶于水,可用于增加水中氧气含量。
(1)CaO2中氧元素的化合价为_____。
(2)如图,先将 CaO2溶于水,较长时间后,气球变大 振荡、静置,然后再上层清液中缓缓通入CO2,出现图现象。写出CaO2与H2O反应的化学方程式_____。
查看答案和解析>>
科目: 来源:江苏省2018届九年级上学期期末考试化学试卷 题型:实验题
结合图回答问题
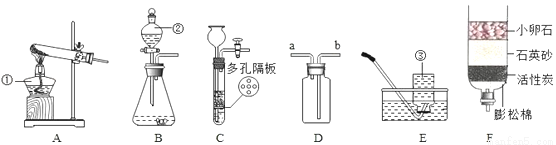
(1)仪器名称:①_____;②_____。
(2)用氯酸钾和二氧化锰制氧气,可选用装置_____(选填序号)和 E 组合,化学方程式 为_____,二氧化锰的作用是_____。
(3)实验室可用装置B或C制 H2,C 装置相对于B的优点有_____,用D装置收集 H2,气体应从_____(选填“a”或“b”)端通入。
(4)F 为简易净水装置,相当于化学实验中的_____装置。向该装置处理过的水中,加入少量肥皂水振荡,产生较多浮渣,说明是水_____(填“硬”或“软”),若要得到纯水,还需 要进行_____(填操作名称)。
查看答案和解析>>
科目: 来源:江苏省2018届九年级上学期期末考试化学试卷 题型:流程题
工业上生产电石(CaC2)并制备重要工业原料乙炔(CxHy)流程如图1所示:
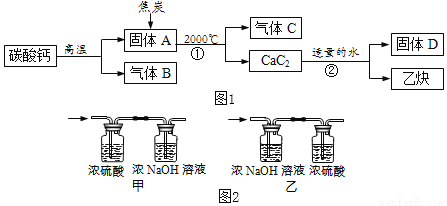
【资料】
①碳酸钙高温分解可得两种氧化物。
②浓硫酸具有强吸水性,NaOH溶液能吸收CO2。
【讨论】
(1)C、B组成元素相同,C有毒,反应①化学方程式为_____。
(2)D微溶于水,溶解度随温度升高而减小,D的化学式是_____。
【测定乙炔组成】
资料:一个乙炔分子有四个原子构成。
(3)将一定量的乙炔(CxHy)完全燃烧,并将生成的气体缓缓通过如图2所示的_____(选填“甲”或“乙”)装置,并再缓缓通一段时间的N2,并记录实验数据于如表中。
装置 | 反应前质量 | 反应后质量 |
浓硫酸 | 125.3g | 127.1g |
浓NaOH溶液 | 78.2g | 87.0g |
(4)实验中“缓缓通一段时间的N2”的目的是_____。
(5)计算:乙炔中碳元素质量为_____g,氢元素质量为_____g,乙炔化学式为_____。
(6)反应②的化学方程式为_____。
查看答案和解析>>
科目: 来源:江苏省2018届九年级上学期期末考试化学试卷 题型:填空题
找规律,填空:
(1)地壳中元素含量:O、Si、_____(写符号)、Fe、Ca;
(2)化合价:HClO4、HClO3、HClO、_____(写化学式)、HCl;
(3)物质的组成:CH4(甲烷)、C2H6(乙烷)、C3H8(丙烷)、C4H10(_______)、________(戊烷)。
查看答案和解析>>
科目: 来源:江苏省2018届九年级上学期期末考试化学试卷 题型:推断题
下图表示某些物质间转化关系。已知D是一种最常见液体,C为紫红色金属,E为黑色固体。A、B、M、F为气体,F能参与绿色植物的光合作用。请回答:

(1)E的化学式______;
(2)蓝色溶液中一定含有的溶质是______________(写化学式);
(3)写出下列反应的化学方程式:①__________;②__________;实验室进行反应①时,常加入少量稀硫酸,其目的是__________。
(4)工业上可用A和F合成乙醇(C2H6O),反应中A和F的质量比为__________。
查看答案和解析>>
科目: 来源:江苏省2018届九年级上学期期末考试化学试卷 题型:填空题
(一)铁的应用和防护
1.我国在西汉时期就有“曾青得铁则化为铜”之说,用化学方程式表示其原理______________。
2.铁生锈的主要过程为
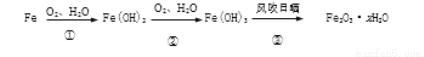
(1)写出转化①的化学方程式________________________
(2)转化③生成Fe2O3·xH2O,则x≤____________(x为整数)。
3.请提出防止铁生锈的一条措施________________________________。
查看答案和解析>>
科目: 来源:江苏省2018届九年级上学期期末考试化学试卷 题型:综合题
(二)铁的化合物应用
黄铁矿(主要成分是FeS2),是一种重要的化工原料,可用来制备硫酸和炼铁。
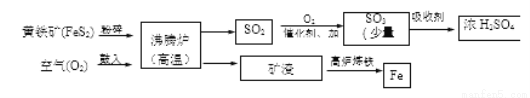
1.工业上将黄铁矿粉碎的目的是____________________。
2.生产硫酸后的尾气中含有SO2,如直接排放可能会造成环境问题是__________________。
3.高炉炼铁的化学方程式为__________________________。
4.150吨含FeS2 80%的黄铁矿理论上最多可以制得98%的浓硫酸________________吨。
查看答案和解析>>
科目: 来源:江苏省2018届九年级上学期期末考试化学试卷 题型:综合题
(三)铁的冶炼和探究
取24.0g Fe2O3粉末,小组同学用下图装置模拟炼铁,并测定反应后固体成分。
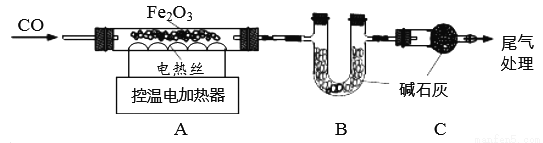
资料:碱石灰可吸收H2O和CO2。
1.连接装置,先______________________,再装入药品。
2.实验时先通入CO,目的是______________________________。
3.控制A中温度在700℃至固体全部变黑,继续通CO至冷却。
(1)通过测定装置B中固体的质量变化,可准确求得装置A中剩余固体质量。装置C的作用是____。
(2)现直接测得装置A中剩余固体质量为19.2g。则装置B中固体应增重________________g。
4.经分析A中剩余固体19.2g为Fe和FexOy的混合物,向其中加入足量的稀H2SO4充分反应,得H2 0.3g。
(1)固体中Fe质量为__________________g。
(2)FexOy的化学式为__________________
查看答案和解析>>
科目: 来源:天津市2018届九年级下学期第一次月考(结课)化学试卷 题型:单选题
我们每天生活在不断变化的物质世界里.下列变化属于化学变化的是( )
A. 瓷碗破碎 B. 石蜡熔化 C. 纸张燃烧 D. 湿衣晾干
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com