
科目: 来源:广西壮族自治区兴业县山心二中2019届九年级下学期第一次学情调研化学试卷 题型:填空题
某化工厂与相邻的化肥厂联合设计了以下制备 (NH4)2SO4的工艺流程。在下图流程中,沉淀池里物质发生的主要化学反应为CO2+2NH3+CaSO4(微溶)+_____===_____+(NH4)2SO4。
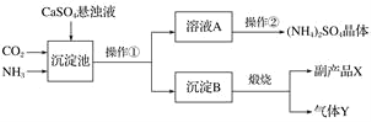
(1)该工艺流程中可循环使用的物质为_____(填化学式)。进入沉淀池选用CaSO4悬浊液而不用CaSO4溶液的理由是_____。沉淀B高温煅烧反应的化学方程式为_____。
(2)实验室里操作①称为_____,进行此操作时,用到的玻璃仪器有玻璃棒、_____、烧杯。操作②的流程是加热浓缩、_____结晶、过滤获得纯净(NH4)2SO4晶体。洗涤所得晶体时不用水,而用饱和(NH4)2SO4溶液的目的是_____。
(3)从绿色化学和资源综合利用的角度说明上述流程的主要优点是_____。
查看答案和解析>>
科目: 来源:广西壮族自治区兴业县山心二中2019届九年级下学期第一次学情调研化学试卷 题型:填空题
化学是造福人类的科学。
(1)能源化学——使用新能源汽车可节约化石燃料。化石燃料包括煤、天然气和_____。
(2)农业化学——化肥对提高农作物产量具有重要作用。尿素属于_____(填“氮”“磷”或“钾”)肥。
查看答案和解析>>
科目: 来源:广西壮族自治区兴业县山心二中2019届九年级下学期第一次学情调研化学试卷 题型:填空题
下列化肥中,从外观即可与其他化肥相区别的是_____
A 硫酸钾 B 硝酸铵 C 磷矿粉 D 氯化钾
查看答案和解析>>
科目: 来源:广西壮族自治区兴业县山心二中2019届九年级下学期第一次学情调研化学试卷 题型:填空题
常见的盐的组成填表:
名称 | 化学式 | 阴离子 | 阳离子 |
氯化钠 | _____ | _____ | _____ |
碳酸钠 | _____ | _____ | _____ |
碳酸氢钠 | _____ | _____ | _____ |
碳酸钙 | _____ | _____ | _____ |
硫酸铜 | _____ | _____ | _____ |
查看答案和解析>>
科目: 来源:广西壮族自治区兴业县山心二中2019届九年级下学期第一次学情调研化学试卷 题型:填空题
从考古文物出土情况来看,金器保存完好,铜器表面会生锈,铁器几乎保存不了,锈迹斑斑或者烂掉,说明金、铜、铁的活动性顺序是______________。
查看答案和解析>>
科目: 来源:广西壮族自治区兴业县山心二中2019届九年级下学期第一次学情调研化学试卷 题型:实验题
草木灰是农家肥料,主要含钾盐。请回答相关问题。
【分离提纯】
(1)在烧杯里放一定量的草木灰,加入水,同时用玻璃棒搅拌。浸出溶液中主要含有的金属阳离子是 。
(2)把烧杯中的草木灰连同浸出液一起过滤。如果滤液仍然浑浊,处理的方法是 。
(3)把滤液倒入蒸发皿里,加热,用玻璃棒搅拌。当蒸发到 时,停止加热。
【成分探究】
取(3)所得的晶体少量溶于水,分到两支试管中。
(4)第一支:滴加盐酸,产生能使澄清的石灰水变浑浊的气体。请写出化学方程式:
①加盐酸: ;
②产生浑浊: 。
(5)第二支:滴加酚酞溶液后,溶液变为 色,说明溶液呈碱性。为证明溶液呈碱性是由CO32-引起的,再向试管中加入 〔可供选择试剂:澄清石灰水、KCl溶液(呈中性)、CaCl2溶液(呈中性)〕,此时发生反应的方程式为 ,当看到 时即可证明。因此,草木灰 (填“能”或“不能”)与铵态氮肥混合施用。
查看答案和解析>>
科目: 来源:广西壮族自治区兴业县山心二中2019届九年级下学期第一次学情调研化学试卷 题型:科学探究题
草木灰是农家肥料,主要含钾盐。请回答相关问题。
【分离提纯】
(1)在烧杯里放一定量的草木灰,加入水,同时用玻璃棒搅拌。浸出溶液中主要含有的金属阳离子是 。
(2)把烧杯中的草木灰连同浸出液一起过滤。如果滤液仍然浑浊,处理的方法是 。
(3)把滤液倒入蒸发皿里,加热,用玻璃棒搅拌。当蒸发到 时,停止加热。
【成分探究】
取(3)所得的晶体少量溶于水,分到两支试管中。
(4)第一支:滴加盐酸,产生能使澄清的石灰水变浑浊的气体。请写出化学方程式:
①加盐酸: ;
②产生浑浊: 。
(5)第二支:滴加酚酞溶液后,溶液变为 色,说明溶液呈碱性。为证明溶液呈碱性是由CO32-引起的,再向试管中加入 〔可供选择试剂:澄清石灰水、KCl溶液(呈中性)、CaCl2溶液(呈中性)〕,此时发生反应的方程式为 ,当看到 时即可证明。因此,草木灰 (填“能”或“不能”)与铵态氮肥混合施用。
【答案】(1)K+ (2)重新过滤 (或再过滤一次);(3)出现大量固体(或余少量液体);
(4)K2CO3+2HCl=2KCl+CO2↑+H2O; Ca(OH)2+CO2=CaCO3↓+H2O;
(5)红;CaCl2溶液;K2CO3+CaCl2=CaCO3↓+2KCl;红色褪去(或消失),产生白色沉淀;不能
【解析】试题根据题中的叙述,草木灰是农家肥料,主要含钾盐,故1)在烧杯里放一定量的草木灰,加入水,同时用玻璃棒搅拌。浸出溶液中主要含有的金属阳离子K+;(2)把烧杯中的草木灰连同浸出液一起过滤。如果滤液仍然浑浊,说明没有过滤完全,故应该重新过滤,(3)把滤液倒入蒸发皿里,加热,用玻璃棒搅拌。当蒸发到出现大量固体(或余少量液体)时停止加热,以防止结晶析出的固体物质受热飞溅;(4)①加盐酸生成能使澄清石灰水变浑浊的气体,说明草木灰中含有碳酸根离子,故反应方程式为:K2CO3+2HCl=2KCl+CO2↑+H2O; ②产生浑浊的原因是Ca(OH)2+CO2=CaCO3↓+H2O;(5)根据溶液显碱性,根据碱性溶液的性质,故滴加酚酞溶液后,溶液变为红色;为证明溶液呈碱性是由CO32-引起的,所加试剂要与碳酸根反应产生明显现象即可证明,故根据酸碱盐的性质再向试管中加入CaCl2溶液;反应的方程式为K2CO3+CaCl2=CaCO3↓+2KCl,当看到,产生白色沉淀,红色褪去(或消失)时即可证明。因此,草木灰不能与与铵态氮肥混合施用,以免产生氨气降低肥效。
考点:物质分离提纯的方法、酸碱盐的性质
【题型】实验题
【结束】
28
在一支试管中放入一小段镁条(已擦去氧化膜),再向试管中加入一定量的盐酸,镁条表面有_________产生,反应的化学方程式是_________.
(发现问题)为了再次观察上述反应现象,小林同学用较长的镁条重做上述实验,但发现了异常现象,试管中出现了白色沉淀.
(实验验证1)小林同学针对两次实验的不同,设计对比实验方案,探究出现异常现象的原因.
试管(盛有同体积同浓度的盐酸) | ① | ② | ③ | ④ |
镁条长度 | 1cm | 2cm | 3cm | 4cm |
相同的实验现象(省略题干现象) | 快速反应,试管发热,镁条全部消失 | |||
沉淀量差异(恢复至20℃) | 无 | 少量 | 较多 | 很多 |
(得出结论)镁条与盐酸反应产生白色沉淀与_________有关.
(追问)白色沉淀是什么物质?
(查阅资料)①20℃时,100g水中最多能溶解氯化镁54.8g.
②镁能与热水反应产生一种碱和氢气;
③氯化银既不溶于水也不溶于稀硝酸.
(做出猜想)猜想一:镁;猜想二:氯化镁;猜想三:氢氧化镁,猜想的依据是_________ (用化学方程式表示).
(实验验证2)将白色沉淀洗涤干净,分别取少量沉淀于A、B、C试管中,进行如表实验:
试管 | 操作 | 现象 | 结论 |
A | 加入足量盐酸 | _________,白色沉淀_________ | 猜想一不正确,但这种白色沉淀能溶于盐酸 |
B | 加入足量水 | 白色沉淀_________ | 猜想二不正确 |
C | 加入适量稀硝酸 | 白色沉淀消失 | 原白色沉淀中含有的离子是:Mg2+、_________ |
继续滴加几滴硝酸银溶液 | 出现大量白色沉淀 |
(拓展延伸)足量镁与盐酸反应过程中,溶液会经历从酸性到碱性并且碱性逐渐增强的过程,从而促使白色碱式氯化镁的生成.
查看答案和解析>>
科目: 来源:广西壮族自治区兴业县山心二中2019届九年级下学期第一次学情调研化学试卷 题型:实验题
在一支试管中放入一小段镁条(已擦去氧化膜),再向试管中加入一定量的盐酸,镁条表面有_________产生,反应的化学方程式是_________.
(发现问题)为了再次观察上述反应现象,小林同学用较长的镁条重做上述实验,但发现了异常现象,试管中出现了白色沉淀.
(实验验证1)小林同学针对两次实验的不同,设计对比实验方案,探究出现异常现象的原因.
试管(盛有同体积同浓度的盐酸) | ① | ② | ③ | ④ |
镁条长度 | 1cm | 2cm | 3cm | 4cm |
相同的实验现象(省略题干现象) | 快速反应,试管发热,镁条全部消失 | |||
沉淀量差异(恢复至20℃) | 无 | 少量 | 较多 | 很多 |
(得出结论)镁条与盐酸反应产生白色沉淀与_________有关.
(追问)白色沉淀是什么物质?
(查阅资料)①20℃时,100g水中最多能溶解氯化镁54.8g.
②镁能与热水反应产生一种碱和氢气;
③氯化银既不溶于水也不溶于稀硝酸.
(做出猜想)猜想一:镁;猜想二:氯化镁;猜想三:氢氧化镁,猜想的依据是_________ (用化学方程式表示).
(实验验证2)将白色沉淀洗涤干净,分别取少量沉淀于A、B、C试管中,进行如表实验:
试管 | 操作 | 现象 | 结论 |
A | 加入足量盐酸 | _________,白色沉淀_________ | 猜想一不正确,但这种白色沉淀能溶于盐酸 |
B | 加入足量水 | 白色沉淀_________ | 猜想二不正确 |
C | 加入适量稀硝酸 | 白色沉淀消失 | 原白色沉淀中含有的离子是:Mg2+、_________ |
继续滴加几滴硝酸银溶液 | 出现大量白色沉淀 |
(拓展延伸)足量镁与盐酸反应过程中,溶液会经历从酸性到碱性并且碱性逐渐增强的过程,从而促使白色碱式氯化镁的生成.
【答案】【题干】气泡;Mg+H2SO4═MgSO4+H2↑;【实验验证1】【得出结论】镁条长度;
【做出猜想】Mg+2H2O=Mg(OH)2+H2↑;【实验验证2】
试管 | 操作 | 现象 | 结论 |
A | 加入足量盐酸 |
| 猜想一不正确,但这种白色沉淀能溶于盐酸 |
B | 加入足量水 | 白色沉淀 不消失 | 猜想二不正确 |
C | 加入适量稀硝酸 | 白色沉淀消失 | 原白色沉淀中含有的离子是:Mg2+、Ag+ |
【解析】
试题【题干】镁与稀硫酸反应生成硫酸镁溶液和氢气,在一支试管中放入一小段镁条(已擦去氧化膜),再向试管中加入一定量的盐酸,镁条表面有气泡产生,反应的化学方程式是Mg+H2SO4═MgSO4+H2↑;【做出猜想】由小林同学的实验,镁条长度越长,产生白色沉淀越多,则镁条与盐酸反应产生白色沉淀与镁条长度有关;由题意,镁能与热水反应产生一种碱和氢气,即镁与热水反应生成氢氧化镁沉淀和氢气,猜想三为氢氧化镁,反应的化学方程式为:Mg+2H2O=Mg(OH)2+H2↑;【实验验证2】A、镁与稀盐酸反应生成氯化镁和氢气,由实验结论,猜想一不正确,但这种白色沉淀能溶于盐酸,则没有气泡产生,白色沉淀消失;B、20℃时,100g水中最多能溶解氯化镁54.8g,易溶于水,由实验结论,猜想二不正确,则加入足量水,白色沉淀不消失;C、加入适量稀硝酸,白色沉淀消失,说明白色沉淀能与酸反应;继续滴加几滴硝酸银溶液,出现大量白色沉淀,说明生成了不溶于硝酸的白色沉淀,次沉淀应为氯化银沉淀,则原白色沉淀中含有的离子是:Mg2+、Ag+。
考点:考查实验探究物质变化的条件和影响物质变化的因素;金属的化学性质;酸的化学性质;化学方程式书写的知识。
【题型】科学探究题
【结束】
29
某化学小组利用如图所示装置(图中固定装置已略去)测定铜锌合金中锌的质量分数,探究过程如下:
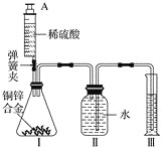
①连接实验装置并检查装置气密性。
②向装置Ⅰ中的锥形瓶加入2.0g的铜锌合金样品粉末,由注射器缓缓注入稀硫酸,待到锥形瓶中不再产生气体时,准确读取注射器内读数,减少10.5mL稀硫酸,同时立即夹紧弹簧夹,移出装置Ⅲ中的导管,准确读取量筒内水的体积为214.0mL(注:样品中的杂质不参加反应
③装置Ⅰ中剩余固体物质经过适当处理后,准确称量其质量为1.4g
④该小组的三位同学利用实验过程测得不同数据,计算铜锌合金样品中锌的质量分数
甲同学利用装置Ⅰ中反应前后固体的质量进行计算;
乙同学利用装置Ⅰ中加入稀硫酸的量进行计算;
丙同学利用装置Ⅲ中量取水的体积进行计算,并查得:在标准状况下,氢气的密度为0.09gL-1。
回答下列问题:
(1)装置Ⅰ中反应的化学方程式为___,实验过程中须加入稀硫酸至不再产生气体,目的是___。
(2)步骤③中称量剩余固体之前的正确操作是_______、洗涤、干燥。
(3)根据实验测定的数据,上述三位同学中________(填“甲”、“乙”或“丙”)同学无法进行计算样品中锌的质量分数。
(4)化学小组同学发现:按照丙同学的方案进行计算,致使实验结果出现较大偏差。以下因素可能造成偏差的有________(填标号)。
A 移出装置Ⅲ时,导管内留存了一部分水
B 实验测量前,没有排除装置Ⅰ中的空气
C 数据处理时,未排除加入稀硫酸所占的体积
查看答案和解析>>
科目: 来源:广西壮族自治区兴业县山心二中2019届九年级下学期第一次学情调研化学试卷 题型:单选题
某化学小组利用如图所示装置(图中固定装置已略去)测定铜锌合金中锌的质量分数,探究过程如下:

①连接实验装置并检查装置气密性。
②向装置Ⅰ中的锥形瓶加入2.0g的铜锌合金样品粉末,由注射器缓缓注入稀硫酸,待到锥形瓶中不再产生气体时,准确读取注射器内读数,减少10.5mL稀硫酸,同时立即夹紧弹簧夹,移出装置Ⅲ中的导管,准确读取量筒内水的体积为214.0mL(注:样品中的杂质不参加反应
③装置Ⅰ中剩余固体物质经过适当处理后,准确称量其质量为1.4g
④该小组的三位同学利用实验过程测得不同数据,计算铜锌合金样品中锌的质量分数
甲同学利用装置Ⅰ中反应前后固体的质量进行计算;
乙同学利用装置Ⅰ中加入稀硫酸的量进行计算;
丙同学利用装置Ⅲ中量取水的体积进行计算,并查得:在标准状况下,氢气的密度为0.09gL-1。
回答下列问题:
(1)装置Ⅰ中反应的化学方程式为___,实验过程中须加入稀硫酸至不再产生气体,目的是___。
(2)步骤③中称量剩余固体之前的正确操作是_______、洗涤、干燥。
(3)根据实验测定的数据,上述三位同学中________(填“甲”、“乙”或“丙”)同学无法进行计算样品中锌的质量分数。
(4)化学小组同学发现:按照丙同学的方案进行计算,致使实验结果出现较大偏差。以下因素可能造成偏差的有________(填标号)。
A 移出装置Ⅲ时,导管内留存了一部分水
B 实验测量前,没有排除装置Ⅰ中的空气
C 数据处理时,未排除加入稀硫酸所占的体积
【答案】(1) ;使样品中的锌完全反应;(2)过滤;(3)乙;(4)AC;
;使样品中的锌完全反应;(2)过滤;(3)乙;(4)AC;
【解析】
试题(1)由于铜排在了氢的后面,所以与酸不反应,反应物是锌和硫酸,生成物是硫酸锌和氢气,氢气后面标上上升符号;实验过程中须加入稀硫酸至不再产生气体,目的是使样品中的锌完全反应;(2)从铜和硫酸锌溶液的混合物中得到铜,先进行过滤,得到带有硫酸锌溶液的铜,再进行洗涤除去表面的硫酸锌,再进行干燥除去水即可;(3)根据加入稀硫酸的量进行计算需要知道稀硫酸的溶质质量分数,而题中没有告知;(4)由于锌与硫酸反应生成硫酸锌和氢气时,放出热量,如果没等冷却到室温,根据热涨冷缩的原理可知进入量筒中水偏多,所以误认为得到的氢气多,再就是数据处理时,未排除加入稀硫酸所占的体积,计算的结果就偏大;
考点:金属的化学性质;化学方程式;实验误差分析;
点评:熟记金属活动性顺序表,知道排在氢之前的金属和稀盐酸或者硫酸反应生成氢气,而排中氢之后的金属和稀盐酸或者稀硫酸不生成氢气;化学反应中物质的质量比都是纯净物之间的质量比,而溶液中溶质的质量=溶液质量×溶质质量分数;本题容易出错的地方是对实验结果的评价,要知道锌与硫酸反应放出热量,会造成相应的误差,必须冷却到室温才能进行观察和计算。
【题型】实验题
【结束】
30
用1000t含氧化铁80%的赤铁矿石,理论上可以炼出含铁96%的生铁的质量是多少?
查看答案和解析>>
科目: 来源:广西壮族自治区融安县大巷乡中学2019届九年级下学期第一次调研化学试卷 题型:单选题
向某盐酸中逐滴加入氢氧化钠溶液,所得溶液的pH与加入氢氧化钠溶液的质量关系曲线图合理的是( )
A. 
B. 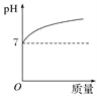
C. 
D. 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com