
科目: 来源:江苏省苏州市2019届九年级下学期中考一模化学试卷 题型:单选题
下列物质的转变不能一步实现的是
A. CO2→O2 B. SO3→H2SO4
C. Cu(OH)2→ CuSO4 D. Cu (NO3)2→ CuCl2
查看答案和解析>>
科目: 来源:江苏省苏州市2019届九年级下学期中考一模化学试卷 题型:单选题
下列各组离子在水中能大量共存的是
A. H+、K+、Cl-、OH- B. Mg2+、Ba2+、Cl-、SO42-
C. K+、Zn2+、Cl-、NO3- D. Na+、Ca2+、OH-、CO32-
查看答案和解析>>
科目: 来源:江苏省苏州市2019届九年级下学期中考一模化学试卷 题型:单选题
一定质量的甲烷在不充足的氧气中燃烧,甲烷完全反应,生成物只有CO、CO2和H2O,且总质量为20.8g,其中H2O的质量为10.8g,则CO2的质量为( )
A. 5.6g B. 8.8g C. 4.4g D. 4.8g
查看答案和解析>>
科目: 来源:江苏省苏州市2019届九年级下学期中考一模化学试卷 题型:填空题
化学就在我们身边,人类的生存与发展都离不开化学。
(1)为了预防侏儒症,儿童可以适当补充_____元素。
(2)长期饮用硬水对人体健康不利,生活中硬水软化的常用方法是_____。
(3)在车船的表面喷涂油漆,防止铁生锈的原理是_____。
(4)山药中含有碱性皂角素,皮肤沾上会奇痒难忍。可以涂上厨房中的_____来止痒。
(5)高铁的机身采用铝合金材料,下列不属于该合金性质的是_____(填字母)。
A 硬度大 B 耐腐蚀 C 密度大
查看答案和解析>>
科目: 来源:江苏省苏州市2019届九年级下学期中考一模化学试卷 题型:简答题
根据下列反应事实写出相应的化学方程式。
(1)过氧化氢溶液和二氧化锰混合制氧气:_____。
(2)铜和硝酸银溶液反应:_____。
(3)在高温下一氧化碳还原氧化铁:_____。
(4)酒精(C2H6O)完全燃烧:_____。
(5)硫酸与氨水中和生成硫酸铵和水:_____。
查看答案和解析>>
科目: 来源:江苏省苏州市2019届九年级下学期中考一模化学试卷 题型:简答题
溶液与人们的生活息息相关。
(l)下表是三种物质在不同温度时的溶解度,根据表中信息回答问题。
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | 氯化钠 | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
硝酸钾 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 | |
氢氧化钙 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 |
①80℃的氢氧化钙饱和溶液降温至40℃,所得溶液是氢氧化钙的_____(填“饱和”或“不饱和”)溶液。
②60℃硝酸钾饱和溶液105g,若降温至20℃,析出硝酸钾晶体的质量是_____。
③20℃时,将20gNaCl加入50g水中,充分溶解,所得溶液的溶质质量分数为_____。(计算结果精确到0.1%)
④向20℃的氢氧化钙饱和溶液中加入少量生石灰,再恢复至20℃,此时溶液中钙离子数目比加入生石灰前溶液中钙离子数目_____(填“增大”“不变”或“减小”);溶液中钙离子浓度比加入生石灰前溶液中钙离子浓度_____(填“增大”“不变”或“减小”)。
⑤从硝酸钾和氯化钠(少量)的混合物中分离出硝酸钾的方法是_____(填“蒸发结晶”或“降温结晶”)。
(2)列式计算:用100g18%的氯化钠溶液配制0.9%的生理盐水,需要加水多少亳升?_____(水的密度为1.0g·mL-1)
查看答案和解析>>
科目: 来源:江苏省苏州市2019届九年级下学期中考一模化学试卷 题型:实验题
下列装置常用于实验室制取气体。请回答问题:
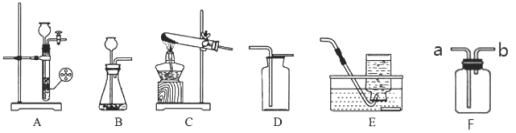
(1)实验室用装置C制取氧气的化学方程式_____;如果收集的氧气将用于做铁丝燃烧实验,则收集装置最好选用_____(在A~E中选填字母);若用F装置排水法收集氧气,则应将氧气从_____(填“a端”或“b端”)通入。
(2)实验室制二氧化碳,用发生装置_____(填字母),可以控制反应的发生和停止。
(3)氨气是一种无色、有强烈刺激性臭味的气体,极易溶于水,水溶液呈碱性。实验室常用加热氯化铵和熟石灰两种固体混合物来制取氨气。某兴趣小组的同学设计如图G~J所示装置对氨气的制取、性质进行探究。
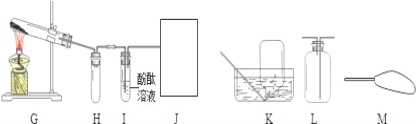
①装置H的作用是_____。
②根据氨气的性质,J处应选择的最佳收集装置为_____。(填“K”、“L”或“M”)
查看答案和解析>>
科目: 来源:江苏省苏州市2019届九年级下学期中考一模化学试卷 题型:流程题
MgSO4•7H2O是一种重要的化工原料,某工厂以一种镁矿石(主要成分为SiO2和MgCO3,还含有少量FeCO3,其它成分忽略)为原料制备MgSO4•7H2O的主要流程如图:
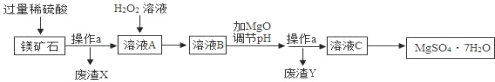
查阅资料:①SiO2既不溶于水也不溶于稀硫酸。
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
阳离子 | Mg2+ | Fe2+ | Fe3+ |
开始沉淀时的pH | 9.1 | 7.6 | 1.9 |
沉淀完全时的pH | 11.1 | 9.7 | 3.2 |
请回答下列问题:
(1)MgCO3溶于稀硫酸的化学方程式为_____。
(2)为了让镁矿石与稀硫酸充分反应,提高原料利用率,可采取的措施为_____(填字母)。
A 将镁矿石粉碎 B 降低反应温度 C 用稀硫酸多次浸泡
(3)“溶液A”中加入H2O2溶液会生成Fe2(SO4)3,该反应的化学方程式为_____。
(4)选用MgO调节pH使Fe3+转化为沉淀,而不选用NaOH的原因是_____。
(5)加氧化镁调节后溶液的pH范围是_____(用不等式表示)。
查看答案和解析>>
科目: 来源:江苏省苏州市2019届九年级下学期中考一模化学试卷 题型:实验题
为验证水的组成元素及探究水在电极端所发生的变化,兴趣小组用如图1所示装置(夹持仪器省略)进行实验:
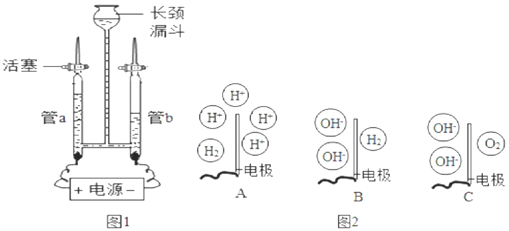
查阅资料:硫酸钠可增强水的导电性,可认为在电解水过程中不反应,硫酸钠溶液呈中性。
Ⅰ.验证水的组成元素
步骤一:向长颈漏斗中加水(含少量Na2SO4)至充满管a和管b,关闭活塞,接通电源,一段时间后关闭电源。
步骤二:检验管中气体。
(1)电解过程观察到的现象有:_____。
(2)用燃着的木条分别置于玻璃管尖嘴口,打开活塞,若观察到气体燃烧产生淡蓝色火焰,则证明气体为H2;若观察到_____,则证明气体为O2。
(3)若要确定水中氢、氧元素的原子个数比,需要测定_____。
Ⅱ.探究水在电极端所发生的变化
步骤一:向装置中重新加滴有酚酞的水(含少量Na2SO4)至充满管a和管b,保持活塞打开,接通电源,一段时间后关闭电源。
(1)实验中发现管b电极附近的溶液迅速变红,管a电极附近的溶液仍为无色,用pH试纸测定管a电极附近的溶液,pH小于7。说明管a电极附近的溶液呈_____性(选填“酸”、“碱”或“中”),管b电极附近的溶液呈碱性。
(2)图2中能表示电解时管b中水在电极端所发生变化的结果的是_____(填对应选项的字母)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com