
科目: 来源:江苏中考真题 题型:填空题
 2FeO+CO2,反应前Fe2O3的质量为160克,反应过程中,Fe2O3的转化率(参加反应的Fe2O3与反应前的Fe2O3的质量比)用a表示,固体中铁元素与氧元素的质量比用mFe/mFeO表示。
2FeO+CO2,反应前Fe2O3的质量为160克,反应过程中,Fe2O3的转化率(参加反应的Fe2O3与反应前的Fe2O3的质量比)用a表示,固体中铁元素与氧元素的质量比用mFe/mFeO表示。
 2Fe3O4+CO2;Fe3O4+3CO
2Fe3O4+CO2;Fe3O4+3CO 2FeO+CO2,反应后的固体中mFe/mO=21/8时固体的成分可能有三种情况:①Fe3O4;②_________(填化学式、下同);③______________。
2FeO+CO2,反应后的固体中mFe/mO=21/8时固体的成分可能有三种情况:①Fe3O4;②_________(填化学式、下同);③______________。查看答案和解析>>
科目: 来源:辽宁省中考真题 题型:计算题
查看答案和解析>>
科目: 来源:辽宁省中考真题 题型:计算题
查看答案和解析>>
科目: 来源:内蒙古自治区中考真题 题型:计算题
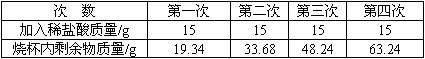
查看答案和解析>>
科目: 来源:云南省中考真题 题型:计算题
 2nCH3CH2OH+2nCO2↑[注:(C6H10O5)n的相对分子质量是162n ]。计算(结果保留1位小数):
2nCH3CH2OH+2nCO2↑[注:(C6H10O5)n的相对分子质量是162n ]。计算(结果保留1位小数):查看答案和解析>>
科目: 来源:0103 期中题 题型:计算题
查看答案和解析>>
科目: 来源:四川省中考真题 题型:计算题
查看答案和解析>>
科目: 来源:四川省中考真题 题型:计算题
查看答案和解析>>
科目: 来源:四川省中考真题 题型:计算题

查看答案和解析>>
科目: 来源:山东省中考真题 题型:计算题
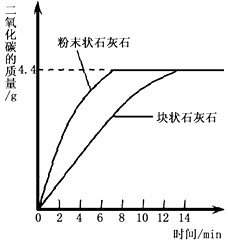
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com