
科目: 来源:山东省泰安市泰山区2019-2020学年九年级上学期期末化学试卷 题型:单选题
淡化海水可采用膜分离技术(如图所示),水分子可以透过淡化膜(海水中其他离子不能透过)进人左侧的池子,从而得到淡水。以下分析中正确的是
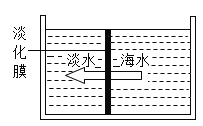
A.右侧池中海水的密度不变
B.淡化膜可用滤纸代替
C.右侧池中溶质的质量分数变大
D.海水淡化的过程无需外界提供能量
查看答案和解析>>
科目: 来源:山东省泰安市泰山区2019-2020学年九年级上学期期末化学试卷 题型:单选题
下列对应的化学方程式书写正确的是
A.工业上用赤铁矿(主要成分是Fe2O3)炼铁:3CO+Fe2O3=3CO2+2Fe
B.用含有还原性铁粉的麦片补铁:2Fe+6HCl=2FeCl3+3H2↑
C.用氢氧化钠处理含硫酸的废水:2NaOH+H2SO4=Na2SO4+2H2O
D.制取硫酸铜:Cu+H2SO4=CuSO4+H2↑
查看答案和解析>>
科目: 来源:山东省泰安市泰山区2019-2020学年九年级上学期期末化学试卷 题型:单选题
下列实验现象与对应结论均正确的是
选项 | 现象 | 结论或解释 | |
A | 打开盛有浓盐酸瓶塞 | 观察瓶口有大量白烟 | 浓盐酸具有挥发性 |
B | 向灼热的Fe2O3中通入CO | 黑色粉末逐渐变为红色 | CO具有还原性 |
C | 将硝酸铵固体加入水中 | 溶液温度降低 | 硝酸铵溶解过程只发生扩散吸热 |
D | 分别向Cu(NO3)2 溶液和CuSO4溶液加人NaOH溶液 | 都有蓝色沉淀产生 | 两种溶液中都含有Cu2+ |
A.A B.B C.C D.D
查看答案和解析>>
科目: 来源:山东省泰安市泰山区2019-2020学年九年级上学期期末化学试卷 题型:单选题
要除去下列物质中混有的少量杂质,所选用的试剂及操作方法均正确的是
选项 | 待提纯物质(括号内为杂质) | 选用的试剂及操作方法 |
A | NaCl固体( Na2CO3) | 加入足量稀盐酸,蒸发 |
B | H2SO4(HCl) | 加入过量BaCl2溶液,过滤 |
C | CO2(HCl) | 通过足量的NaOH溶液,干燥 |
D | Fe粉( CuO) | 加入适量的稀硫酸,过滤 |
A.A B.B C.C D.D
查看答案和解析>>
科目: 来源:山东省泰安市泰山区2019-2020学年九年级上学期期末化学试卷 题型:填空题
选择下列适当的物质填空(填数字序号):
①氯化钠②小苏打③硫酸钡④可燃冰⑤熟石灰⑥不锈钢
(1)常用作调味品的是_____________;
(2)用于制作医疗器械_______;
(3)钡餐透视时服用的试剂__________;
(4)改良酸性土壤的碱_________;
(5)用作糕点发酵剂的是______;
(6)被科学家誉为“未来能源”的化石燃料的是_______。
查看答案和解析>>
科目: 来源:山东省泰安市泰山区2019-2020学年九年级上学期期末化学试卷 题型:填空题
海洋是巨大的资源宝库,请你运用学过的知识回答下列问题:
(1)人类所需要的下列物质.可以从海洋中获取的是_______(填字母序号);
①石油②无机盐③可燃冰④锰结核⑤淡水
A ①③④⑤
B ①④⑤
C ②③④
D 全部
(2)从海水中获取粗盐的方法是_______;
(3)从海水中获得淡水方法很多,在世界范围内能做到规模化和产业化的主要有______;和____;
(4)从海水或卤水中制备金属镁流程图(图中A表示加入的物质)如下:
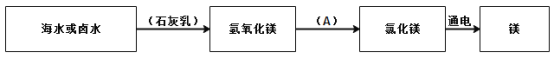
①加入石灰乳的作用是_______;
②写出氢氧化镁→氯化镁的化学方程式______;
③在最后一步能量的转化是_______;转化为________。
查看答案和解析>>
科目: 来源:山东省泰安市泰山区2019-2020学年九年级上学期期末化学试卷 题型:流程题
我国科学家侯德榜创立候氏制碱法为纯碱和化肥工业的发展做出了杰出贡献。下图1是候氏制碱法的反应原理,图2是相关物质的溶解度曲线,请结合图示回答下列问题:
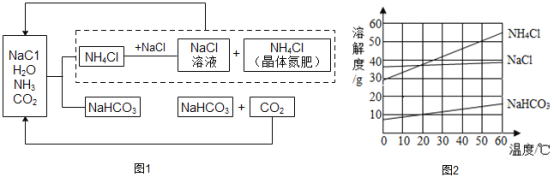
(1)制碱的主要反应原理:NaCl+NH3+CO2+H2O=NH4Cl+NaHCO3,生成的碳酸氢钠和氯化铵哪种物质首先析出?_______;理由是_______;
(2)该过程中除水外.能够循环利用的物质是_______;
(3)写出NaHCO3→Na2CO3 反应的化学方程式____________;
(4)50°C时,向100g水中加入55g氯化铵充分搅拌,所得溶液为____(填“饱和”或“不饱和”)溶液;
(5)60°C时,向等质量的氯化钠、碳酸氢钠、氯化铵中,分别加人水配成饱和溶液,所得溶液的质量由小到大的顺序是_______。
查看答案和解析>>
科目: 来源:山东省泰安市泰山区2019-2020学年九年级上学期期末化学试卷 题型:实验题
某兴趣小组同学为验证酸的性质,做了以下A、B、C、D、E五组实验。结合图示分析回答下列问题:
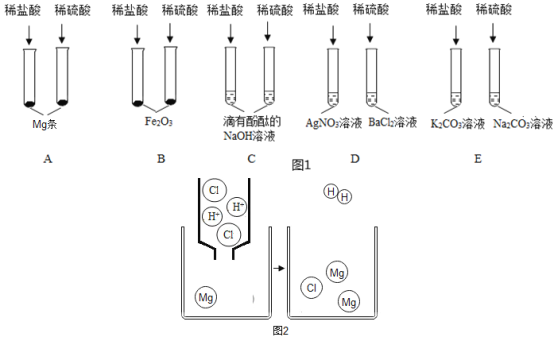
(1)A组试管中都有氢气产生,结合图2分析,该微粒转化过程是Mg原子失去电子变成Mg2+,H+_________;(填“失去”或“得到”)电子变成H2;
(2)B组试管中实验现象相同,写出其中任一试管中发生反应的化学方程式_______;
(3)能证明C组试管中发生反应的现象是__________;
(4)E组试管中都能产生使澄清石灰水变浑浊的气体,其原因是________;
(5)上述五组实验中没有体现酸的通性的一组是________(填字母序号)。
查看答案和解析>>
科目: 来源:山东省泰安市泰山区2019-2020学年九年级上学期期末化学试卷 题型:科学探究题
某粗盐样品中除含有不溶性固体杂质外,可能还含有少量氯化镁、氯化钙、硫酸钠,化学兴趣小组在实验室开展如下探究活动,请完成下列问题。
探究一:除去粗盐中不溶性杂质。
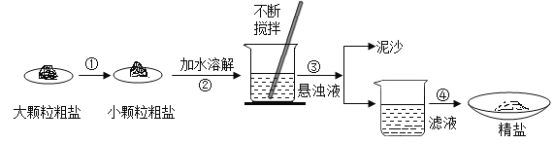
(1)操作①中必须用到的一种仪器是_____________(填字母序号,下同);
A 研钵
B 量筒
C 烧杯
D 试管
(2)操作③的名称是______________;该操作中玻璃棒的作用为_______________;
(3)操作④“蒸发结晶”中,用到的器材有:铁架台(铁圈)、坩埚钳、火柴、玻璃棒、石棉网、酒精灯、______________;
(4)如果称得粗盐的质量为5g,称得精盐的质量为5.1g,则下列分析正确的是_____________;
A 精盐的产率一定为98.04%
B 精盐的产率一定为102%
C 蒸发操作中可能有水分没有蒸干
D 溶解操作中可能有粗盐没有溶解
探究二:除去精盐中可溶性杂质提取纯净氯化钠固体(该探究中,微溶物不沉淀)。
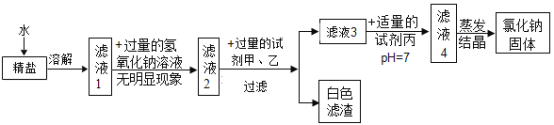
(1)甲试剂为氯化钡溶液、乙试剂为碳酸钠溶液,加入这两种试剂顺序_____________(填“能”或“不能”)颠倒;
(2)在白色滤渣中加入稀盐酸,沉淀部分溶解,结合流程图示推断该精盐中,除NaCl外,一定不含有____(填“化学式”,下同) ,可能含有______________;
(3)写出加人试剂甲发生反应的化学方程式_____________;
(4)加入适量试剂丙的目的是_______________;
(5)若实验过程中不考虑损耗,最终得到的NaCl固体的质盘将___________(填“大于”、“小于”或“等于”)原精盐中NaCl的质量。
查看答案和解析>>
科目: 来源:山东省泰安市泰山区2019-2020学年九年级上学期期末化学试卷 题型:科学探究题
兴趣小组同学在探究金属的化学性质和金属锈蚀的条件时,分别做了如下两个探究实验,请你一起参与,并完成相关问题。
探究一:探究金凤的活动性顺序。
将锌、铁、铜三种金属分别放人稀硫酸、硫酸铜溶液、硝酸银溶液、氯化钠溶液中,观察并记录现象如下表:
金属 | 稀硫酸 | 硫酸铜溶液 | 硝酸银溶液 | 氯化钠溶液 |
锌 | √①剧烈 | √ | √ | 一 |
铁 | √不剧烈 | √② | √ | 一 |
铜 | 一 | 一 | √③ | 一 |
注明:用“√”表示能观察到实验现象,用“一”表示观察不到实验现象。
(1)分别写出①、②中观察到的实验现象________;
(2)③中发生反应的化学方程式为_________;
(3)运用“控制变量法”设计实验方案是化学研究的重要方法。在锌、铁、铜与稀硫酸实验中,需要控制的实验条件除了金属与稀硫酸接触面积稀硫酸的体积、温度以外,还需要控制的条件是_____;
(4)上述实验涉及到的五种金属的活动性由强到弱的顺序是______(用元素符号表示);
(5)若利用上述试剂制取氢气,小明认为应该选择金属锌和稀硫酸反应,而不选择金属铁和稀硫酸反应,其理由是_______;
探究二:探究金属锈蚀的条件。
[实验步骤]在下列五只试管中分别放人完全相同的洁净铁钉,几天后观察铁钉锈蚀的情况。
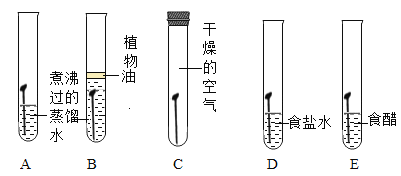
[现象记录]A、D、E中铁钉锈蚀明显,B、C中铁钉不生锈。
[结论与解释](1)对比A、B实验.说明铁锈蚀一定要有_______参加;对比A、C实验,说明铁生锈要有______参加;
(2)试管D和E的实验目的是探究铁在________或_______存在的环境中更易锈蚀;
(3)写出一种防止铁制品生锈的具体方法_______;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com