
科目: 来源:2019年5月福建省厦门市中考二模化学试卷 题型:单选题
下列图像能正确反映对应变化关系的是( )
A. 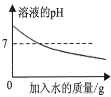 常温下,稀释KOH溶液
常温下,稀释KOH溶液
B.  将浓硫酸露置在空气中
将浓硫酸露置在空气中
C.  一定质量的饱和石灰水中加入生石灰
一定质量的饱和石灰水中加入生石灰
D. 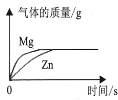 足量粉末状金属分别与等质量、等浓度的稀盐酸反应
足量粉末状金属分别与等质量、等浓度的稀盐酸反应
查看答案和解析>>
科目: 来源:2019年5月福建省厦门市中考二模化学试卷 题型:填空题
镁被誉为“国防金属”。
(1)由图1可知,镁的相对原子质量为___________。
(2)图2为镁元素的某种微粒结构示意图,它的质子数为________,该微粒的符号为_______。
(3)以化合价为纵坐标、物质类别为横坐标所绘制的图像叫价类二维图。图3为镁的价类二维图,则A处的化学式:__________,B处的物质类别是_________。
(4)镁铝合金是镁和铝在高温真空条件下熔炼而成的。该合金不在空气中熔炼的原因是______。该合金是一种储氢材料,完全吸氢后得到MgH2和Al,“储氢过程”属于_______(填“物理”或“化学”)变化。
查看答案和解析>>
科目: 来源:2019年5月福建省厦门市中考二模化学试卷 题型:填空题
水是生命之源。
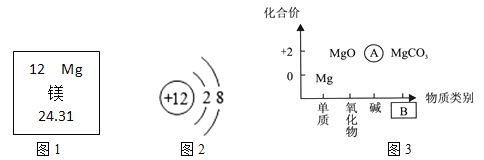
(1)“生命吸管”(如图1)可将普通水净化为饮用水,主要净水流程如图2。(离子交换树脂的主要作用是去除重金属离子、软化水质)
①活性炭的作用是_______(填标号,下同),超滤膜的作用是__________。
a 去除有害菌和部分病毒 b 吸附杂质 c 去除较大的不溶性杂质
②经“生命吸管”处理后的水是硬水还是软水,可加入_______来检验。在生活中,为降低普通水的硬度和杀灭病原微生物,常采用的方法是___________。
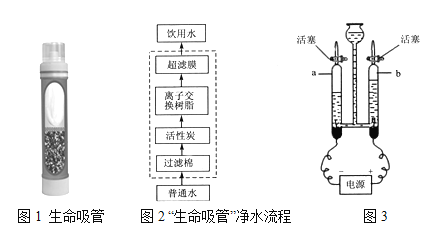
(2)从化学视角认识水的组成和结构。
①用图3装置电解水。发生反应的化学方程式:___________,常用________检验管b中气体。
②保持水的化学性质的最小粒子是______________(填符号,下同)。水分解过程中的最小粒子有______________、______________。
查看答案和解析>>
科目: 来源:2019年5月福建省厦门市中考二模化学试卷 题型:流程题
减少有毒气体排放,变废为宝是保护大气环境的重要措施。
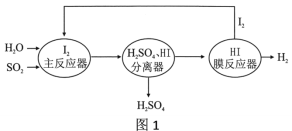
(1)工厂排出的尾气含SO2,可以通过图1工艺流程处理并获得氢气。
①写出主反应器中反应的化学方程式:__________
②膜反应器中化学变化的基本反应类型是___________________。
③该工艺流程中,能被循环利用的物质是______________。
(2)NSR技术通过BaO和Ba(NO3)2的相互转化实现NOx(如NO、NO2)的储存和还原,能降低柴油发动机NOx的排放。以NO为例,其工作原理如图2。
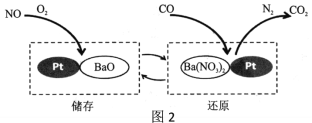
①储存时,部分NO和O2在一定条件下发生化合反应生成NO2,写出化学方程式:_________
②还原时,反应前后化合价发生变化的元素有_____________、____________。
查看答案和解析>>
科目: 来源:2019年5月福建省厦门市中考二模化学试卷 题型:实验题
用W形玻璃管完成下列实验。
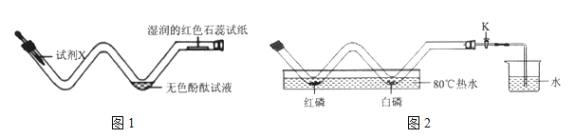
(1)探究微粒的性质
如图1,向玻璃管左端加入试剂X,观察到无色酚酞试液变红,湿润的红色石蕊试纸变蓝,试剂X可能是_____________。从微观角度解释上述现象:____________。
(2)探究燃烧条件,并粗略测定空气中氧气的含量
如图2,在玻璃管中放置足量的红磷和白磷,塞好橡皮塞,关闭K,观察到红磷不燃烧而白磷燃烧。产生上述现象的原因是_____________。若要继续测定空气中氧气的含量,还需进行的操作:__________________,测量相关数据。
查看答案和解析>>
科目: 来源:2019年5月福建省厦门市中考二模化学试卷 题型:流程题
锌锰电池(俗称干电池)在生活中应用广泛,其构造如图1。
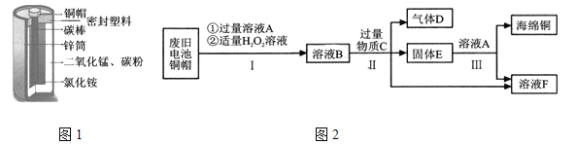
(1)根据图1判断,属于金属材料的有铜帽和______________。
(2)利用废旧电池铜帽(含Cu、Zn)制取海绵铜(Cu),并得到ZnSO4溶液,主要流程如图2。
已知:Cu + H2O2 + H2SO4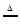 CuSO4 + 2H2O
CuSO4 + 2H2O
①写出过程Ⅱ中生成金属单质的化学方程式:______________。
②过程Ⅲ中加入溶液A充分反应后,还需进行的主要操作是_____________。
③下列说法正确的是________(填标号)。
A 过程Ⅰ中H2O2也有可能分解生成氧气
B 固体E是混合物
C 溶液F含有的ZnSO4比溶液B多
查看答案和解析>>
科目: 来源:2019年5月福建省厦门市中考二模化学试卷 题型:实验题
兴趣小组对粗盐进行提纯,并配制NaCl溶液。实验流程如下图:
(1)操作③的名称是_________。
(2)操作①②③都要用到的一种玻璃仪器是______,在操作②中,这种玻璃仪器的作用是_____
(3)计算精盐的产率,结果偏低,可能的原因是______(写一种)。
(4)配制100g6%的NaCl溶液,若实际配得的溶液溶质质量分数偏大,可能的原因是____(填标号)。
a 称量NaCl所用天平砝码已生锈 b 用量筒取水时俯视读数
c 用量筒取水时仰视读数 d 用残留蒸馏水的烧杯配制溶液
(5)欲配制20g质量分数为3%的NaCl溶液,需要6%的NaCl溶液________mL(假设NaCl溶液的密度均为1.0g·cm-3)。
查看答案和解析>>
科目: 来源:2019年5月福建省厦门市中考二模化学试卷 题型:科学探究题
研究小组设计下列实验方案探究CO2与NaOH溶液是否发生反应。
方案一:
[查阅资料]
①乙醇不与NaOH、Na2CO3、CO2反应;
②25℃时,NaOH和Na2CO3在乙醇中的溶解度如下表:
物质 | NaOH | Na2CO3 |
溶解度/g | 17.3 | <0.01 |
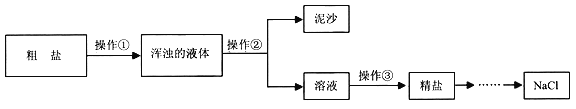
[实验装置] 如图1。
[实验步骤]
i.打开K1,关闭K2,从导管口a通入CO2气体,直至观察到饱和NaOH的乙醇溶液中产生大量沉淀,停止通CO2;
ii.从导管口a通入足量氮气;
iii.关闭K1,打开K2,向装置甲的试管中滴入足量的稀盐酸,观察装置乙的现象。
(1)步骤i产生沉淀的原因是___________________。
(2)步骤ii的目的是____________________。
(3)步骤iii装置乙中产生现象的原因是__________(用化学方程式表示)。
方案二:
[实验装置]
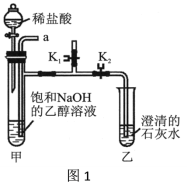
如图2(三颈瓶内集满CO2气体;装药品后的注射器B的活塞用夹子固定)。
[实验步骤]
按以下步骤完成实验,通过相对压强传感器测量瓶内压强的变化。整个实验过程的压强随时间变化如图3。
i.将注射器A内的NaOH溶液注入瓶中,测量压强直至不再改变;
ii.取下夹子,将注射器B内的盐酸注入瓶中,测量压强直至不再改变;
iii.将两个注射器的活塞都拉回原位,并都用夹子固定,测量压强直至不再改变。
(4)检查图2装置气密性的方法:____________。
(5)为缩短①→④中反应的时间,可采取的操作是______________。
(6)写出导致⑤→⑥压强变化的主要反应的化学方程式:________。
(7)步骤iii结束后瓶内压强比注入NaOH溶液前小,其原因是__________。
(8)请结合图3信息,说明NaOH与CO2发生了反应。_________。
查看答案和解析>>
科目: 来源:2019年5月福建省厦门市中考二模化学试卷 题型:计算题
用如图装置测量锌的相对原子质量。取0.114g锌片与足量稀硫酸充分反应,生成42.70mL氢气。已知:①该条件下氢气的密度为0.089g·L-1;②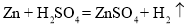 。
。

(1)生成的氢气质量为__________g(保留两位有效数字)。
(2)根据本次实验数据,计算锌的相对原子质量_______(写出计算过程)。
(3)若实验操作无误,分析实验结果出现误差的原因_______。
查看答案和解析>>
科目: 来源:甘肃省白银市会宁县2019-2020学年九年级上学期期中化学试卷 题型:单选题
下列变化属于化学变化的是
A.酒精挥发 B.水结成冰 C.镁带燃烧 D.衣橱中卫生球变小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com