
科目: 来源: 题型:
【题目】用下列序号填空:
①烧杯 ②试管 ③胶头滴管 ④燃烧匙 ⑤加速溶解 ⑥过滤 ⑦引流 ⑧量取,
(1)能直接加热的玻璃仪器 ; (2)吸取或滴加少量液体的仪器 ;
(3)溶解食盐晶体时玻璃棒的作用 ; (4) 取用6.8mL某溶液的操作 。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组在实验室用碳酸钠溶液和熟石灰制取少量氢氧化钠溶液,他们的实验过程和相关数据如图所示。请计算:
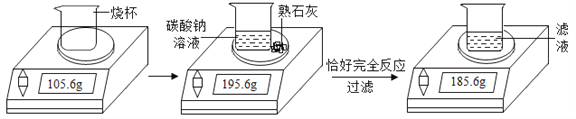
(1)实验中生成沉淀的质量为________g;
(2)所得氢氧化钠溶液中溶质的质量分数。
(反应的化学方程式:Na2CO3+Ca(OH)2==CaCO3↓+2NaOH)
查看答案和解析>>
科目: 来源: 题型:
【题目】向氧化铜和锌粉的混合物中加入一定量的稀硫酸,反应停止后过滤,再向滤液中插入铁片,铁片无变化.以下判断正确的是( )
A. 滤液中一定含有铜和锌 B. 滤液中一定含有Zn2+
C. 滤液中一定含有铜 D. 滤液中一定含有Cu2+
查看答案和解析>>
科目: 来源: 题型:
【题目】某课外兴趣小组为探究铁合金中铁的质量分数,先后进行了四次实验(杂质不与稀硫酸反应,也不溶于水),实验数据如下表:
第一次 | 第二次 | 第三次 | 第四次 | |
所取合金的质量/g | 10 | 10 | 20 | 30 |
所加稀硫酸的质量/g | 100 | 120 | 80 | X |
反应后烧杯内的剩余物/g | 109.8 | 129.8 | 99.8 | Y |
请你认真分析数据,回答下列问题:
(1)上表第四次实验中合金里的铁恰好与稀硫酸完全反应,则其中X= g,Y= g
(2)该铁合金中铁的质量分数是多少?
(3)计算第四次实验反应后溶液中溶质的质量分数?(结果保留至0.1%)。
(2、3小题写出计算步骤。)
查看答案和解析>>
科目: 来源: 题型:
【题目】请选择下列适当的物质,用字母填空(每种物质只可选用一次)。
A 碘酸钾 B 明矾 C 氮气 D 干冰 E 澄清石灰水
(1)可用于灯泡填充气的是 ; (2)能防治甲状腺肿大的是 ;
(3)可用于人工降雨的是 ; (4)常用的净水剂是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】FeO、Fe2O3、和CaCO3的混合物中,已知铁元素的质量分数为56%,则CaCO3的质量分数可能是
A.25% B.10% C.30% D.35%
查看答案和解析>>
科目: 来源: 题型:
【题目】金属在日常生活、工农业生产和科学研究方面应用广泛。
(1)某实验小组为了探究锌与硫酸反应快慢的影响因素,进行了如下实验。
实验编号 | 硫酸的质量分数 (均取20 mL) | 锌的形状 (均取1g) | 氢气的体积(mL) (均收集3分钟) |
① | 20% | 锌粒 | 31.7 |
② | 20% | 锌片 | 50.9 |
③ | 30% | 锌粒 | 61.7 |
④ | 30% | 锌片 | 79.9 |
①用如图装置收集并测量氢气的体积,其中量筒作用是_____________________,氢气应从_____(填e或f或g)管通入。
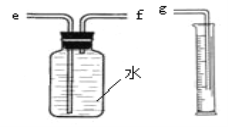
②要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是___________。
③下表是小兵第①组实验的详细数据。
时段(均为1分钟) | 第1分钟 | 第2分钟 | 第3分钟 | 第4分钟 | 第5分钟 | 第6分钟 |
H2的体积 | 3.1mL | 16.7mL | 11.9mL | 9.6mL | 7.6mL | 6.0mL |
请描述锌与硫酸反应的快慢的变化_________________________________________。
解释原因_________________________________________________________。
(2)保险粉(化学式 Na2S2O4)在工农业生产中有广泛的用途,Na2S2O4 在碱性溶液中稳定,在中性和酸性溶液中极不稳定;在 NaCl 存在下,Na2S2O4 在水中溶解度显著下降。Na2S2O4 制备流程如下:
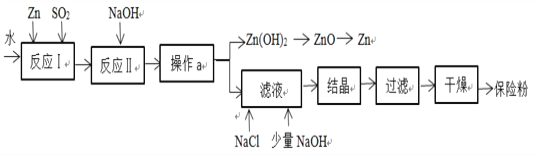
①已知反应Ⅰ的原理为:Zn + 2SO2 == ZnS2O4,反应Ⅱ为复分解反应,反应Ⅱ的化学方程式为______________________________________________。
②操作a的名称为_______________________。
③滤液中含有 Na2S2O4,为使 Na2S2O4 结晶析出还需要加入少量 NaOH 的原因是__________________________, 加入NaCl的原因是_______________________。
④198gZn(OH)2理论上能得到Zn的质量为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com