
科目: 来源: 题型:
【题目】“舌尖上的化学”。以下是厨房中一些实物图。

(1)牛肉富含的营养物质是________。
(2)碘盐中的“碘”是指________(填“元素”“原子”或“单质”)。食用碘盐是为了预防________疾病。(填字母)
a.贫血 b.甲状腺肿大 c.夜盲症
(3)为保障“舌尖上的安全”,下列做法合理的是________。(填字母)
a.霉变大米蒸煮后食用
b.甲醛溶液浸泡虾仁防腐
c.适当使用食品添加剂
查看答案和解析>>
科目: 来源: 题型:
【题目】自行车作为常用的代步工具,既轻便灵活,又符合环保要求,下图是一款自行车的示意图。

(1)所标物质中,属于有机合成材料的是________,属于金属合金的是________,含有的金属元素是________。
(2)车架表面刷漆主要是为了防锈,其原理是什么?请再提出一条可延长自行车使用寿命的建议。
(3)当今自行车外形美观,材质轻便、牢固,除了代步,还可以作为健身工具。由此你对化学与人类生活的关系有何感想?
查看答案和解析>>
科目: 来源: 题型:
【题目】李涛同学撰写的“心目中的原子”短文中,阐述了以下观点,你认为不正确的是
A. 原子是最小的微观粒子 B. 原子可以转化为离子
C. 有些物质是由原子构成的 D. 原子可以“搭建”成分
查看答案和解析>>
科目: 来源: 题型:
【题目】日常生活中使用的塑料袋,有的是用聚乙烯制成的,有的是用聚氯乙烯制成的.小凤对包装食品的塑料袋进行探究,以验证其成分.
【作出猜想】①该塑料袋是用聚乙烯制成的;
②该塑料袋是用聚氯乙烯制成的;
【查阅资料】聚乙烯燃烧生成二氧化碳和水;聚氯乙烯燃烧生成二氧化碳、水和氯化氢;无水硫酸铜是白色粉末,遇水变为蓝色.
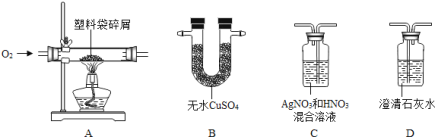
【实验探究】小凤将装置按A、B、C、D顺序连接好后,进行实验.在实验过程中,B、D产生明显现象,C无明显现象,说明塑料袋没有气体生成 (填化学式).B装置的作用是 ;D瓶中发生反应的化学方程式是 .
【实验结论】通过实验证明,猜想 是正确的.
【交流反思】①从化学角度分析,大量使用塑料制品会导致 .
②连接实验仪器时,将B、C位置能否进行交换,理由是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】①能充入食品防腐的气体_______;②能使澄清石灰水变浑浊的气体_______;③空气中二氧化碳增多会引起_______;④二氧化硫、二氧化氮排入空气中会引起_____;⑤能使带火星的木条复燃的气体__________; ⑥ 空气中含量最多的气体是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某活动小组的同学对碳酸钠与稀盐酸反应进行了下列探究:
【探究一】向放有一支燃着的蜡烛的烧杯中加适量碳酸钠和盐酸(如图所示):

(1)蜡烛燃烧变化的现象是: 。
(2)根据该实验现象推测碳酸钠与盐酸反应产生的气体可用于 (写出用途)。
【探究二】利用碳酸钠与盐酸的反应,可否用于验证质量守恒定律进行了探究,实验如下,如图所示,
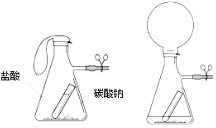
![]()
在(吸滤)瓶中加入适量的碳酸钠粉末,在小试管中加入盐酸。将小试管放入吸滤瓶中,并用止水夹夹住支管处的橡皮管。称量整个装置的质量,记录读数。将吸滤瓶倾斜,使小试管中的盐酸倾倒入瓶中,与碳酸钠粉末反应。可观察到如图二所示的现象。再次称量整个装置的质量,记录读数。
两次读数 (填“是”或“否”)相等。理由是 。
【探究三】碳酸钠与盐酸反应后剩余溶液的成分探究(假设二氧化碳已完全放出,杂质溶于水,不参加反应且呈中性)。甲、乙两同学分析认为剩余溶液中一定含有氯化钠,可能有盐酸或碳酸钠。为验证是否含有盐酸,他们采用了不同方法进行实验,得到了相同的结论。
查找资料:氯化钠溶液呈中性
实验操作 | 实验现象 | 结论 | |
甲 | 取样于试管中,滴加 试液 | 试液变红 | 有盐酸 |
乙 | 取样于试管中,逐滴滴加碳酸钠溶液 |
【探究四】某兴趣小组同学向盛有6.0g纯碱样品的烧杯里加入40.0g盐酸,实验测定完全反应后烧杯中剩余物的质量为43.8g,且溶液显酸性。(假设纯碱样品中的杂质不与盐酸反应)求:
(1)产生的二氧化碳的质量为 g。
(2)纯碱样品中碳酸钠的质量(写出计算过程)。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用如图1所示装置的部分或全部组合后完成如下实验,请回答下列问题:
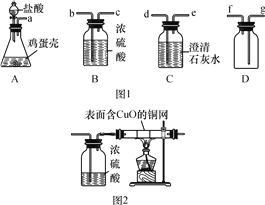
(1)鸡蛋壳的主要成分是碳酸钙,A装置中发生反应的化学方程式为_______________________,A与C相连后C中的现象为________________________。
(2)若将A装置中的药品换成双氧水和二氧化锰,产生的O2经浓硫酸干燥后用D装置收集,导管口的连接顺序应是a→b→c→________。
(3)若将A装置中的药品换成硫酸铜溶液和铁粉,发现生成红色固体物质的同时有较多的气泡放出。老师提示,该反应生成的气体只有一种。
【猜想】放出的气体可能是SO2、O2、H2中的一种,提出猜想的依据是________________。
【资料】SO2易溶于水,化学性质与二氧化碳相似,能使澄清石灰水变浑浊,生成CaSO3。
【方案】依据上述猜想,实验小组同学分别设计了如下方案。
①甲同学认为是O2,则检验方法是________________________________________________。
②乙同学认为是SO2,则只需将装置A、C相连,看澄清石灰水是否变浑浊即可。写出SO2与Ca(OH)2反应的化学方程式:________________________________。
③丙同学在乙同学实验装置的基础上增加了如图2所示的装置,观察到试管中产生的现象是________________________。
【结论】经过实验,得出结论:放出的气体为H2。
(4)在氢气还原氧化铜的实验中,向50 g氧化铜粉末中通氢气,加热一段时间后,测得反应后生成水的质量为9 g。求已反应掉的氧化铜的质量_________________(写出计算过程)。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学调研小组的同学用氢氧化钠和稀盐酸探究中和反应,请你参与以下探究:
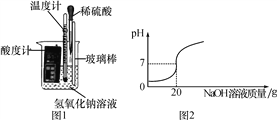
(1)甲组同学取少量的氢氧化钠溶液于烧杯中,用酸度计测得该溶液的pH,同时插入一支温度计,测量溶液的温度(如图1)。用胶头滴管吸取稀盐酸,逐滴加入盛有氢氧化钠溶液的烧杯中,边滴加边搅拌。此时可观察到的现象是酸度计上显示的数据逐渐________(填“增大”“减小”或“不变”),温度计上显示的数据逐渐升高,由此可知,酸和碱的中和反应属于________(填“吸热”或“放热”)反应。
(2)乙组的同学改用固体氢氧化钠与稀盐酸反应来探究中和反应中能量的变化情况,你认为该方案________(填“合理”或“不合理”),原因是________________________________。
(3)丙组同学用另外一瓶氢氧化钠溶液进行实验时,当往烧杯中滴加稀盐酸时,发现有少量的气泡冒出,小组同学根据这一现象进行讨论,一致认为其原因可能是氢氧化钠溶液已经变质,原因是________________________________(写化学方程式)。
(4)丁组同学借助酚酞试液来判断氢氧化钠溶液与稀盐酸发生中和反应时,在烧杯中加入氢氧化钠溶液后,滴几滴酚酞溶液,然后加入一定量稀盐酸,最后溶液为无色。小金认为溶液显中性。小东认为不一定,小东同学设计以下实验进行了验证,结果否定小金的结论:
实验步骤 | 实验现象 | 结论 |
___________________ | __________________ | ___________________ |
(5)戊组同学对本地化工厂排放废水中的盐酸含量进行了测定。取废水50 g,用质量分数为20%的氢氧化钠溶液进行中和,如图2所示。请你计算废水中盐酸的溶质质量分数__________________。(写出具体的计算过程)
查看答案和解析>>
科目: 来源: 题型:
【题目】铁及其化合物是中学化学学习和研究的重要内容。
(1)如图是铁的原子结构示意图。下列说法不正确的是________;
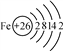
A.铁元素属于金属元素
B.铁原子的质子数为26
C.铁在化学反应中易失去电子
D.铁是地壳中含量最高的金属元素
(2)活性铁粉常用作脱氧保鲜剂,原理是铁和氧气、水反应生成氢氧化铁,该反应的化学方程式为________________________________;单质铁可以和硫酸铁溶液反应生成硫酸亚铁,化学反应方程式为________________________________。
(3)在实验中,进行铁丝在氧气中燃烧的实验时,瓶底放少量的水或砂子目的是_______________;在生活中为防止家中的菜刀生锈,可采取的方法是____________________。
(4)生物浸出技术在金属冶炼中应用广泛。嗜热细菌在酸性水溶液及氧气存在下,能氧化黄铜矿(主要成分CuFeS2)产生硫酸盐,进而生产铜和绿矾(硫酸亚铁晶体),主要流程如下:
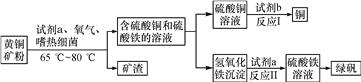
①若反应I的另一种产物最终也可制得绿矾,则试剂b为________;若反应Ⅱ为中和反应,写出该反应的化学方程式________________________________。
②现有100吨杂质质量分数为8%的黄铜矿(杂质不参与反应且不溶于水),经上述流程制得硫酸铁溶液,再向硫酸铁溶液中加入足量的铁粉,请计算能制得硫酸亚铁的质量_______________________(写出计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com