
科目: 来源: 题型:
【题目】碱式碳酸铜是一种用途广泛的化工原料.工业上可用电子工业中刻蚀线路板的酸性废液(主要成分有FeCl3、CuCl2、FeCl2)制备,
【工业制备】
【资料查询】1.反应A中氯酸钠的作用是将FeCl2氧化成FeCl3 . 2.Cu2+、Fe3+生成沉淀时的pH如下:
物 质 | Cu(OH)2 | Fe (OH)3 |
开始沉淀pH | 4.2 | 1.2 |
完全沉淀pH | 6.7 | 3.2 |
(1)滤渣的主要成分是(写化学式).
(2)调节反应A后溶液的pH范围应为 .
(3)反应B的温度如过高,则所得蓝绿色产品中可能会出现的黑色固体是(写化学式).
(4)过滤得到的产品可用蒸馏水洗涤,为检验是否洗涤干净,可取最后一次洗涤液,先加入 , 再滴加 , 观察到 则表明已洗净.
(5)【组成测定】碱式碳酸铜的组成可表示为:aCuCO3bCu(OH)2cH2O.某研究小组设计如下实验装置.
【资料查询】:CuCO3、Cu(OH)2受热易分解,各生成对应的两种氧化物.
充分反应后测得:①A中样品质量为12.0g,②A中剩余固体质量为8.0g,③B装置增重1.8g,④C装置增重2.2g.(各装置均充分吸收,不考虑装置中空气的影响)
B中的试剂是 , C中的试剂是 , D中的试剂是(填字母序号);
a.碱石灰 b.浓硫酸 c.无水硫酸铜 d.浓NaOH溶液
(6)要计算得出样品的组成,只需实验测得四个数据中的三个即可,则可行的组合为(填序号,多选少选不给分).
a.②③④b.①③④c.①②④d.①②③
通过计算可得碱式碳酸铜(aCuCO3bCu(OH)2cH2O)中a:b:c= .
(7)D的作用 . 若将D装置去掉,a值将(填“偏大”、“偏小”或“不变”)
查看答案和解析>>
科目: 来源: 题型:
【题目】工业铁红的主要成分是Fe2O3 , 还含有少量的FeO、Fe3O4 . 为了测定铁红中铁的质量分数,兴趣小组的同学进行了如下实验,请你参与过程分析.
【资料1】草酸晶体(H2C2O43H2O)在浓H2SO4作用下受热分解,化学方程式为:
H2C2O43H2O ![]() CO2↑+CO↑+4H2O
CO2↑+CO↑+4H2O
(1)下列可用作草酸分解制取气体的装置是(填字母编号). 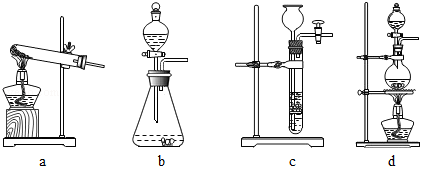
(2)【问题讨论】用图所示装置进行实验: 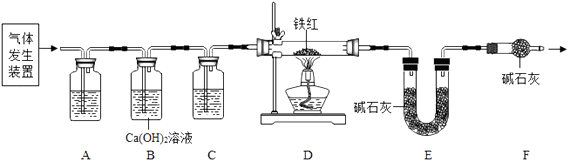
实验前应先 .
(3)进入D中的气体是纯净、干燥的CO,则A、C中的试剂依次是、(填字母编号). a.浓硫酸 b.澄清的石灰水 c.氢氧化钠溶液
(4)B装置的作用是 .
(5)对D装置加热前和停止加热后,都要通入过量的CO,其作用分别是: ①加热前 . ②停止加热后 .
(6)写出D装置中所发生反应的一个化学方程式 .
(7)【数据分析与计算】【资料2】铁的常见氧化物中铁的质量分数:
铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
铁的质量分数 | 77.8% | 70.0% | 72.4% |
称取铁红样品10.0g,用上述装置进行实验,测定铁红中铁的质量分数.
①D中充分反应后得到Fe粉的质量为m g,则<m< .
②实验前后称得E装置增重6.6g,则此铁红中铁的质量分数是 .
【实验评价】
反思1:本实验中如果缺少C装置(不考虑其它因素),则测得样品中铁的质量分数会(填“偏小”、“不变”或“偏大”).
反思2:请指出【问题讨论】中实验装置的一个明显缺陷 .
查看答案和解析>>
科目: 来源: 题型:
【题目】氧化镁在医药、建筑等行业应用广泛,以菱镁矿(主要成分为MgCO3 , 含少量FeCO3 , 其他杂质不溶,也不参加反应)为原料制备高纯氧化镁的实验流程如图1: 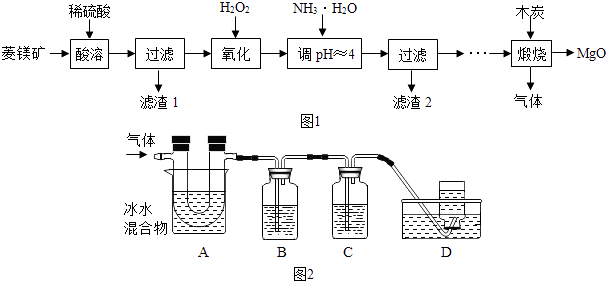
资料:①不同氢氧化物沉淀的pH范围:
氢氧化物 | Fe(OH)3 | Mg(OH)2 |
开始沉淀的pH | 1.5 | 8.6 |
完全沉淀的pH | 3.2 | 11.1 |
②硫在常温下是一种淡黄色固体,硫的熔点约为115.2℃,沸点约为444.7℃;
③高锰酸钾溶液只吸收SO2 , 不吸收CO2;
④碱溶液既吸收SO2 , 又吸收CO2 .
试回答下列问题:
(1)MgCO3与稀硫酸反应的化学方程式为 .
(2)加入H2O2目的是在酸性条件下将FeSO4氧化成Fe2(SO4)3 , 同时生成水,发生反应的化学方程式为 .
(3)加氨水调节溶液的pH约为4的目的是 , 反应的化学方程式为 .
(4)煅烧过程存在以下反应: 2MgSO4+C ![]() 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C ![]() MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C ![]() MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用如图2装置对煅烧产生的气体进行分步吸收或收集.(假设每步反应都完全进行)
①A中现象是:玻璃管壁出现色固体;
②B中盛放的溶液可以是(填字母),实验现象为;
a.Ca(OH)2 溶液 b.Na2CO3 溶液 c.稀硝酸 d.KMnO4溶液
③D中收集的气体是(填化学式).
查看答案和解析>>
科目: 来源: 题型:
【题目】“可燃冰”是蕴藏在海底中的天然气,由天然气与水在高压低温条件下形成的类冰状的结晶物质,被誉为“固体瓦斯”化学式为:CH4nH2O.
(1)可燃冰(CH4nH2O)燃烧的化学方程式;
(2)天然气属于(填“可”或“不可”)再生能源.为缓解能源危机,人们正积极开发利用新能源,下列属于可再生能源的是(填字母序号); a.太阳能 b.石油 c.氢能 d.地热能
(3)目前人类利用太阳辐射能,主要方式是“光﹣热”转换,请列举生活中的一例:;
(4)如图是一种家庭能量储存系统原理示意图,在该系统中,白天利用太阳能电池将太阳辐射能直接转换为电能,给用电器供电并用装置X电解水;夜晚,装置Y是氢﹣氧燃料电池,用于夜晚给用电器供电. 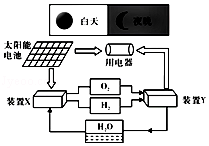
①白天,装置X中电解水的化学方程式为 ,
正极产生的气体为;
②夜晚,装置Y中能转化为电能;
③该系统的下列说法,正确的是(填序号).
A.该系统中能量的最初来源是太阳能
B.装置X工作将电能转化为化学能
C.该系统能实现物质的零排放,保护了环境.
(5)含硫的煤在燃烧时常会产生有害的SO2气体.为防止污染空气,常将燃烧后的气体(烟道气)通入石灰浆来吸收SO2 , 其反应方程式为: . 生成的CaSO3在空气中进一步氧化生成CaSO4 , 其反应方程式为: .
查看答案和解析>>
科目: 来源: 题型:
【题目】柑橘是一类美味的水果.如图为某柑橘的部分营养成分 
(1)请回答:图中的钙、钾、磷是指
A.分子
B.原子
C.元素
D.单质
(2)糖类在人体内转化为葡萄糖后,再经过向人体提供能量;(填“缓慢氧化”或“剧烈氧化”)柑橘中是否存在淀粉,实验室可以用(填试剂名称)来检验.
(3)柑橘适宜生长在pH为6左右的土壤中.若某土壤的pH为3,要经改良后方可种植柑橘.下列物质,既可用来改良土壤酸性,又能作为肥料的物质是 . (填字母序号);
A.生石灰
B.熟石灰
C.过磷酸钙
D.草木灰.
查看答案和解析>>
科目: 来源: 题型:
【题目】在碱性溶液中,一定能大量共存的离子组是( )
A.A13+、NH4+、SO42﹣、Cl﹣
B.Na+、SO42﹣、K+、CO32﹣
C.K+、Fe2+、Cl﹣、NO3﹣
D.Ba2+、Na+、Cu2+、NO3﹣
查看答案和解析>>
科目: 来源: 题型:
【题目】化学语言包括文字语言、符号语言、图表语言等.
(1)请用化学符号填空: ①镁离子;②人体内含量最多的物质;
③碘酒中的溶剂;④耐高温陶瓷氮化铝;
(2)用下列字母序号填空:A.活性炭 B.硫酸铜 C.二氧化硫 D.氧气 ①会形成酸雨的是;②农业上用来配农药波尔多液的是;
③可用于防毒面具的是;④医疗上用于抢救危重病人的是 .
(3)写出下列反应的化学方程式: ①汽车尾气中NO和CO在催化剂作用下生成空气中2种无毒气体;
②用熟石灰中和工厂废液中的硫酸:;
(4)A、B两种物质的溶解度曲线如图. 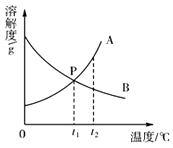
①图中P点的含义是 .
②t2℃时,将A、B两物质的饱和溶液各100g,分别降温到t1℃,所得A溶液的质量B溶液的质量.(填“>”或“=”或“<”)
③欲将t2℃时B物质的饱和溶液变为不饱和溶液,可采用的方法是或 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com