
科目: 来源: 题型:
【题目】根据初中所学的知识并结合下列仪器回答问题:
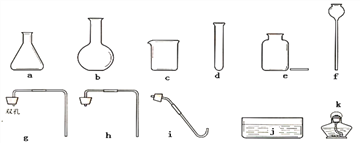
(1)写出仪器的名称: a________、f_________。
(2)实验室选取d、e、i、j、k四种仪器制取并收集氧气时,反应的化学方程式为__________,其中还缺少的仪器是_______________。
(3)对用氯酸钾和二氧化锰的混合物制取O2后的固体残渣(假定已完全反应),通过以下四步实验操作可回收二氧化锰。正确操作的先后顺序是__________(填写选项序号)。
a.烘干 b.溶解 c.过滤 d.洗涤
(4)小明同学在组装实验室制取二氧化碳的发生装置时,除了选用了仪器b、g 外还需选择上述仪器中的_________(填写序号)。反应的化学方程式是________________________。
(5)小琪同学用浓盐酸与大理石在上述装置中反应,制取CO2并检验其有关性质,观察到烧杯中澄清石灰水溶液不变浑浊。造成这一现象的可能原因是_________________________。
(6)下图是测定空气中氧气含量的实验装置图。实验测得硬质玻璃管的容积为25mL,反应前后注射器中空气体积分别为15mL和9mL。
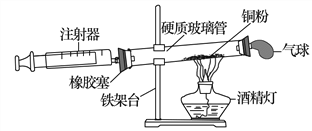
①通常空气中氧气的体积分数约为21%,该实验测得空气中氧气的体积分数为_________,在装置气密性良好的情况下,造成误差的可能原因是______________________(只要写出1种)。
② 装置中的气球可以帮助形成密闭体系,还可能起到的作用是_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(11分)学习化学一年后,同学们对课本上“活动性较强的金属一般可以将位于其后面的金属从它们的盐溶液中置换出来”以及“支持燃烧的气体一般是氧气”这两句话产生了质疑。在老师的帮助下,用金属钠来探究下列问题:
【提出问题】
1.金属钠能否置换出硫酸铜溶液中的铜?
2.金属钠能否在其他气体(如:CO2)中燃烧?
【查阅资料】金属Na性质活泼,常温下,它极易与氧气反应生成白色固体氧化钠,氧化钠溶于水生成氢氧化钠。金属钠还可以与水剧烈反应放出氢气。
【实验探究】
实验一:①在实验室中,金属钠保存在煤油中;
②用镊子从煤油中取出一小块金属钠,用滤纸吸干表面煤油后投入硫酸铜溶液中,观察到溶液中出现蓝色沉淀,但没有红色的物质析出;
③按照步骤②将金属钠投入水中,待反应结束后滴加酚酞溶液,发现溶液变红。
实验二:将燃烧的钠迅速伸入盛有CO2的集气瓶中,观察到钠在CO2中继续燃烧,反应后冷却,瓶内附着黑色颗粒,并粘附着白色物质。
【问题讨论】
(1)金属钠保存在煤油中的原因是: 。
(2)根据上述资料写出钠块投入水中发生反应的化学方程式: 。
(3)实验二中生成的黑色颗粒是 ,而白色物质可能是什么呢?
①同学们围绕白色物质可能是什么产生如下猜想:甲认为白色物质是氧化钠,乙认为是碳酸钠,丙认为是氧化钠和碳酸钠的混合物,丁认为是氢氧化钠。
我认为丁的猜想是错误的,理由是 。
②对白色物质是什么进行实验再探究,方案设计如下:
方案1:取该样品少量于试管里,加入适量的水,振荡,过滤,向滤液中加入无色酚酞试液,观察到溶液变成红色,结论:白色物质中一定有氧化钠。
方案2:取该样品少量于试管里,滴加足量盐酸,溶液中有气泡冒出,结论:白色物质中一定有 。
方案3:取该样品少量于试管里,加入适量的水,振荡,过滤,向滤液中加入过量的 溶液(供选试剂:A.石灰水B.氯化钙溶液 C.硫酸铜溶液),出现白色沉淀,然后过滤,再向溶液里滴加无色酚酞试液,无明显现象出现。则 (在甲、乙、丙中选)的猜想成立。
③评价与反思:小娟同学认为实验方案1得出的结论不正确,其理由是 ;
【拓展应用】测定实验中使用的标有质量分数为16%的盐酸(图1)的实际质量分数。
为了测定,小明配制了20%的氢氧化钠溶液100g。然后在烧杯中加入一定量配得的氢氧化钠溶液,再逐滴加入该盐酸,恰好完全反应时测得剩余物总量为45 g。整个实验过程用pH测定仪测定滴加过程中溶液的pH。图2为测定仪打印出的滴加盐酸的质量与溶液pH的关系图。
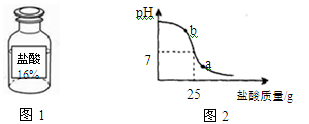
请以此次测定的数据,列式计算该盐酸的实际质量分数?
(4)该盐酸的实际质量分数与标签上标出的质量分数不一致的可能原因 (不考虑误差)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是A、B、C三种物质的溶解度曲线,下列分析正确的是
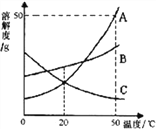
A. A的溶解度比B大
B. 将50℃时A、B的饱和溶液降温到20℃时,晶体析出A大于B
C. 50℃时把50gA放入50g水中能得到A的饱和溶液,其中溶质与溶剂的质量比为1:2
D. 将20℃时A、B、C三种物质的饱和溶液升温至50℃时,这三种溶液的溶质质量分数的大小关系是B>A=C
查看答案和解析>>
科目: 来源: 题型:
【题目】根据图示信息和已学知识判断,下列说法正确的是( )

A. 镁元素位于元素周期表的第三周期,镁原子核内有12个质子
B. 氯的相对原子质量为35.45g,在化学变化中,氯原子易得电子
C. 当X=8时,该微粒属于稀有气体元素的原子
D. 镁离子与氯离子的电子层数相等
查看答案和解析>>
科目: 来源: 题型:
【题目】用数轴表示某些化学知识直观、简明、易记。下列数轴表示错误的是
A. 硫及其化合物与化合价的关系:![]()
B. 银、铜、铁的金属活动性强弱: ![]()
C. 物质形成溶液的pH:![]()
D. 形成溶液时的温度:
查看答案和解析>>
科目: 来源: 题型:
【题目】我国矿物种类齐全,储量丰富。工业上从从含有金属元素的矿石中提炼金属。其中赤铁矿是炼铁的主要原料。请回答下列问题:
I.铁制品广泛应用于生产、生活中。
(1)铁合金属于________。A.合成材料 B.复合材料 C.金属材料 D.天然材料
(2)铁钉生锈,属于_____变化(选填“物理”“化学”):下图是探究铁钉在不同条件下发生生锈的实验,其中铁锈蚀最快的是______(选填字母)。
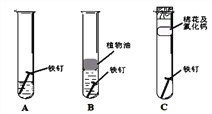
II.赤铁矿(主要成分为Fe2O3)可用于炼铁。
(3)在Fe2O3中,铁、氧元素的质量比为____________。
(4)某钢铁厂每天消耗2000t含Fe2O376%的赤铁矿石,该厂理论上可日产含Fe98%的生铁的质量是________________?(需要写出计算过程计算,结果保留一位小数)
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组同学以纯碱和熟石灰为原料制烧碱,其化学方程式为________________。
该小组同学将反应后混合物过滤,将滤液蒸发,即得到烧碱固体。
【问题与发现】该小组同学所得到固体一定是纯净的NaOH吗?
【猜想与假设】小明:纯净的NaOH 小军:NaOH和Na2CO3的混合物 小华:__________________
【探究与验证】三位同学分别设计下列方案,对自己的猜想进行验证。实验操作、现象和结论如下表,请参与他们的探究并完成所缺内容。
实验操作 | 现象 | 结论 | |
小明 | 取少量样品,溶于适量水形成溶液后,滴加几滴酚酞试液 | 溶液变红 | 猜想成立 |
小军 | 取少量样品,溶于适量水形成溶液后,滴加足量_________ | 有气泡产生 | 猜想成立 |
小华 | 取少量样品,溶于适量水形成溶液后,滴加碳酸钠溶液 | __________ | 猜想不成立 |
【反思与评价】请你根据实验流程对小明同学设计的方案进行合理的评价:__________。
【拓展探究】小军同学定量分析所制取氢氧化钠固体样品中氢氧化钠的含量。
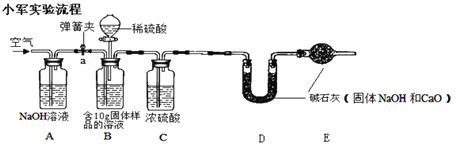
实验步骤如下①检查好装置气密性,装好药品后连接并固定好装置;
②打开弹簧夹a,通入一段时间的空气,精确称量D装置质量记录为100g;
③关闭弹簧夹a,打开B装置中的分液漏斗,滴入稀硫酸,直到瓶内无气泡产生;
④打开弹簧夹a, 继续通入一段时间空气,再精确称量D装置质量记录为101.1g ……
实验分析:(1)实验中C装置作用是______________。
(2)实验步骤④中,继续通入一段时间空气的目的是__________________。
(3)样品中氢氧化钠的含量为________。(计算结果精确到小数点后一位);如果没有装置E,则测定结果与实际结果相比会_____(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】晓楠发现了许多有趣的化学问题,请你帮助她解释或解决这些问题.
(1)①天然降水中会溶解部分空气里的二氧化碳气体。因此正常雨水的pH___7(选填“>”或“=”或“<”)。
②发生火灾时,消防员利用高压水枪灭火的主要原理是________。
③电解水实验可以得出水的组成,该反应的化学方程式为___________。
(2)现将300g 25%的NaCl溶液稀释为10%的NaCl溶液,需要加水的质量为______g;配制的主要步骤有:计算、________、混匀、装瓶并贴上标签;实验中用到的玻璃仪器有胶头滴管、烧杯、____________(两种)和试剂瓶。
(3)①甲、乙两物质的溶解度曲线如下图所示。20℃时,将等质量的甲、乙两种固体,分别加入盛有10 g水的A、B试管中,充分溶解后,可观察到如图所示的现象。则20℃________t℃(填“>”、“<”或“=”)。

②20℃时,对A试管进行如下操作,最终A试管中溶液溶质的质量分数一定发生变化的是_________(填字母序号)。
A.加10g水 B.加入少量甲物质 C.升温到40℃ D.蒸发部分溶剂,恢复到20℃
(4)酒精是可再生能源,酒精完全燃烧的化学方程式为______________。
(5)将一定量铜粉和镁粉的混合物放入一定量的硝酸银溶液中,充分反应后过滤,得到固体物质和无色滤液,下列说法正确的是_______________。
A.滤出的固体中一定含有银和铜 B.向滤出的固体中加稀盐酸一定有气泡产生
C.滤液中一定含有硝酸银和硝酸镁,一定没有硝酸铜
D.滤液中一定含有硝酸镁,一定没有硝酸银和硝酸铜
查看答案和解析>>
科目: 来源: 题型:
【题目】银铜合金广泛用于航空工业,切割废料中回收银并制备铜化工产品的工艺流程如图所示:【已知Al(OH)3和Cu(OH)2开始分解的温度分别为450℃ 和80℃ ,Al(OH)3和NaOH能发生反应NaAlO2和水。】
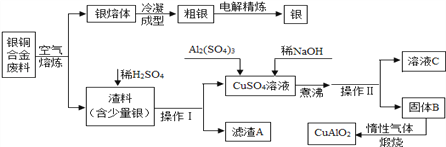
(1)写出铜银合金废料在空气中熔炼时的化学反应方程式___________________。
(2)操作Ⅰ的名称为____________。
(3)写出向CuSO4溶液中加入Al2(SO4)3和稀NaOH其中的一个化学反应方程式____________,其基本反应类型为__________________。
(4)固体混合物B的组成为______;在生成固体B的过程中,必须控制NaOH的加入量,原因是_________。
(5)煅烧固体B获得CuAlO2时通入惰性气体的作用______________,CuAlO2中铜元素的化合价为________价。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)二氧化硅可用于制造分离膜,利用“膜分离”技术可使二氧化碳穿过分离膜被氨水吸收(如右下图)生成可用作化肥的碳酸氢铵(NH4HCO3)。
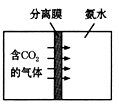
①碳酸氢铵属于______(填“氮肥”、“磷肥”、“钾肥”或“复合肥”)。
②二氧化硅的化学式为________。
③氨水中含有一定浓度的氢氧根离子,氢氧根离子的符号是_________。
(2)请从入![]() 中选择合适的元素,按物质的分类写出相应物质的化学式(各写一例)。①氧化物:_______;②酸:________;③盐:________。
中选择合适的元素,按物质的分类写出相应物质的化学式(各写一例)。①氧化物:_______;②酸:________;③盐:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com