
科目: 来源: 题型:
【题目】钛白粉的化学名称是二氧化钛(TiO2),无毒,有极佳的白度和光亮度,是目前性能最好的白色颜料。以主要成分为TiO2的金红石作原料,通过氯化法可以制备钛白粉,主要流程如下:
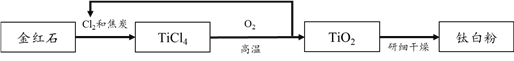
(1)TiO2中钛元素的化合价是_______。
(2)补全TiCl4与氧气反应的化学方程式:TiCl4+O2![]() □Cl2 +________
□Cl2 +________
(3)根据绿色化学理念,生产过程中应充分利用原料和减少有害物质排放。从绿色化学的角度看,该工艺流程的明显优点是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】小明同学对家中久置的袋装固体食品防腐剂的成分产生了兴趣(品名和成分如图所示),于是和同学一起,设计实验进行探究:

[提出问题]久置固体食品防腐剂的成分是什么?
[查阅资料]铁与氯化铁溶液在常温下发生反应生成氯化亚铁。
[作出猜想]久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3 。
[实验探究]甲同学的探究方案如下表:
实验操作 | 实验现象 | 实验结论 |
(1)取少量固体放于试管中,加足量蒸馏水溶解,静置后取上层清液滴加无色酚酞溶液 | 固体溶解时试管外壁发烫,试管底部有不溶物,溶液变红。 | 固体中一定含有_______和氢氧化钙。此过程的化学方程式_______。 |
(2)另取少量固体放于试管中,滴加足量的稀盐酸 | 固体逐渐消失,有大量无色气体产生,得到浅绿色溶液。 | 固体中一定含有Fe ,一定不含 Fe2O3 |
(3)将步骤(2)中产生的气体通入到澄清的石灰水中 | ________ | 固体中一定含有CaCO3 |
[交流与反思]
(1)“504双吸剂”中的铁粉可以吸收空气中的_______、______。
(2)实验操作(2)的实验现象里“有大量无色气体产生”, 根据甲同学的整体探究方案推测,无色气体的成分是一定含有______,可能含有________。
(3)乙同学认为甲同学的实验中不能得出一定含Ca(OH)2的结论,理由是______。
(4)丙同学认为甲同学的实验并不能得出一定不含Fe2O3的结论,理由是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】水善利万物
(1)水的组成:
下图是水电解实验,由此获得的信息是:
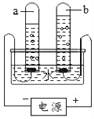
①a、b两极气体体积比为___________;
②该反应的化学方程式是____________。
(2)水的净化:
①生活中常通过____________方法降低水的硬度;
②经家用电解离子水器净化可得到酸、碱性不同的水,且各有其用途:
水的应用 | 浸泡蔬菜 | 日常饮用 | 烹饪 | 洗涤器皿 |
pH | 10.0 | 9.5 | 9.0 | 5.5 |
取上表用于____________的水样品中,滴入石蕊试液变红色。
(3)水的用途:
水是常见溶剂,下图为甲、乙、丙三种物质的溶解度曲线;
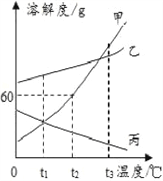
t1℃时,甲、乙、丙三种物质的溶解度大小关系是__________;
②t2℃时,甲的饱和溶液中溶质和溶剂的质量比为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】请根据下列所示实验装置图回答问题:
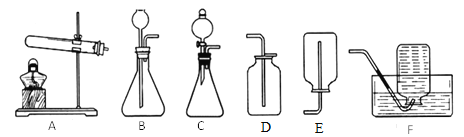
(1)写出装置图中标号仪器的名称:a______;b_______。
(2)若A、F组成制取某气体M的装置,制取此气体的化学方程式为______;用B装置也可制取M气体,其发生装置中的化学反应方程式是_______。
(3)C装置与B装置相比,其优点是(写一点即可)______。
(4)将浓盐酸和大理石在B装置中混合后发生剧烈反应,此反应的化学方程式是______,但把生成的气体直接通入澄清石灰水时,石灰水没有变浑浊。你认为石灰水没有变浑浊的原因是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是A、B两种物质的溶解度曲线。下列叙述错误的是
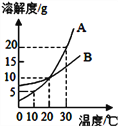
A. 30℃时,向100克水中加入25克A物质,充分溶解后所得溶液是饱和溶液
B. 30℃时,将B物质的不饱和溶液转变为饱和溶液,可用恒温蒸发溶剂的方法
C. 从A、B两种物质的溶解度曲线可以推知,任何物质的饱和溶液降温后一定有晶体析出
D. 分别将A、B两种物质的饱和溶液从30℃降温到20℃,其溶质质量分数都逐渐减小,直至相等
查看答案和解析>>
科目: 来源: 题型:
【题目】钛(Ti)被称为“21世纪的金属”。
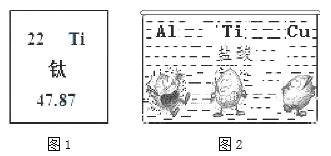
(1)图1是钛元素在周期表中的信息,其核内质子数为___________。
(2)图2是Ti、Al、Cu三种金属在稀盐酸里的反应现象,则这三种金属的活动性由大到小的顺序是___。
(3)下图是利用钛白粉(TiO2)生产海绵钛(Ti)的工艺流程:
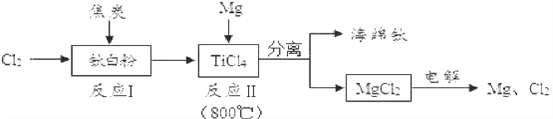
①反应Ⅰ的化学方程式为:2Cl2+TiO2+2C TiCl4+2X,则X的化学式为_____________。
②反应Ⅱ的化学方程式是______________。
③该工艺流程中,可以循环使用的物质 有镁和___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】从微观角度上,许多化学反应都可用模拟图像来形象地表示其反应发生的过程,下图中“![]() ”和“
”和“![]() ”分别表示不同元素的原子。下列关于图中所示反应的说法中,不正确的是
”分别表示不同元素的原子。下列关于图中所示反应的说法中,不正确的是
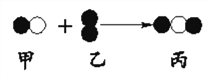
A. 该反应一定是化合反应
B. 反应中甲、乙、丙的分子个数比为2:1:2
C. 甲、丙可能都是氧化物
D. 若ag甲与bg乙充分反应一定能生成(a+b)g丙
查看答案和解析>>
科目: 来源: 题型:
【题目】过氧化钙晶体(化学式为:CaO2·yH2O,化学式中的“yH2O”称为结晶水),常温该晶体下为白色,能溶于酸,难溶于水、乙醇,是一种温和的氧化剂,常用于鱼类长途运输的增氧剂等。
(1) 过氧化钙晶体可用下列方法制备:
CaCl2+H2O2+NH3+H2O![]() CaO2·yH2O↓+NH4Cl。
CaO2·yH2O↓+NH4Cl。
用如下制取装置制备过氧化钙晶体。
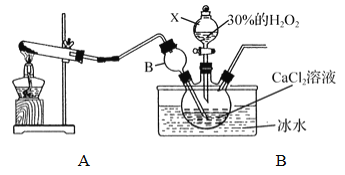
①装置A中生成的气体为________,此装置在初中化学实验中可用于制取_______(填某气体);仪器X的名称为________。
②装置C采用冰水浴控制温度在0℃左右,可能的原因主要有:
Ⅰ. 该反应是放热反应,温度低有利于提高CaO2·yH2O产率;
Ⅱ. ____________________________
③反应结束后,经过滤、洗涤、低温烘干可获得CaO2·yH2O。检验晶体已洗涤干净的方法为:取最后一次洗涤液,滴加____________,若__________,则晶体已经洗涤干净。
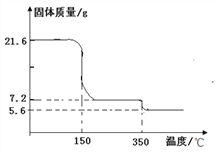
(2)为确定过氧化钙晶体的组成,某化学兴趣小组称取21.6克晶体用热分析仪对其进行热分解实验,并绘制成固体质量与温度关系图(过氧化钙晶体受热时会先失去结晶水),根据下图可知y=_______, 350℃时发生的分解反应方程式为_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学逛超市时发现食品添加剂中有“碳酸氢铵”,感觉很惊讶,“碳酸氢铵”是臭粉啊,怎么可以放进食品?于是开展了以下探究,请你帮助完成下列相关问题。
(1)查阅资料:
①食用级碳酸氢铵比较纯净,可作膨松剂,一般用在油炸食品中,水蒸食品中不用;
②常温常压下,1体积水约能溶解600体积氨气,其水溶液呈弱碱性。
③碱石灰是氧化钙和氢氧化钠的混合物。
(2)产生疑惑:臭粉为何可以作膨松剂?为何一般适用于油炸食品而不适用于水蒸食品?
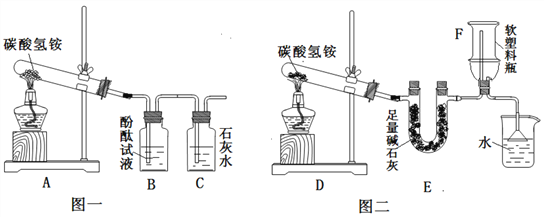
(3)实验设计:实验装置如图,图一是检验装置,图二是收集装置,取适量碳酸氢铵分别置于两试管中,按如图进行实验。
(4)现象与分析:
①图一:B中现象是_________________,C中发生反应的化学方程式是 _______________ 。
②图三:装置E的作用是_________________,用F装置收集氨气,说明氨气具有_________________性质,取下F,塞紧橡皮塞,用注射器向F中注入少量水,震荡,可看到的现象是_________________,拔出橡皮塞闻到氨味。
(5)解释与结论:①有臭味的碳酸氢铵添加到食品中,如果油炸,则含有的少量碳酸氢铵受热时完全分解,产生的气体使食品膨胀,且生成物可以迅速挥发而离开食品,没有残留物,其臭味会消失,碳酸氢铵受热发生反应的化学方程式是_________________②添加碳酸氢铵的食品如果水蒸,则 _________________。
通过上述探究该明白了:高纯度的碳酸氢铵可以作为食品添加剂,但同一食品添加剂并不适合所有食品,使用食品添加剂需严格控制用量。
查看答案和解析>>
科目: 来源: 题型:
【题目】臭氧(O3)是对于环境有重要影响的物质,兴趣小组对其进行如下探究。
【查阅资料】①O3微溶于水:
②O3常用于消毒等,但浓度超标时对人体有毒副作用;
③品红溶液为红色,遇强氧化剂(如O3)会变味无色。
探究一·臭氧的制备
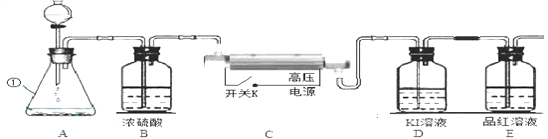
(1)写出仪器①名称___________。
(2)图中A装置制取氧气的化学方程式是______________。
(3)将A中制得的氧气一次通过图中B→E装置。
①B中浓硫酸的作用是____________________。
②实验开始,先通过一段时间氧气,合上C装置电源开关,在电火花作用下O2会转化为O3,该反应是____(填“物理”或“化学”)变化。
探究二·臭氧含量的测定
D中反应原理为:2KI+O3+H2O 2KOH+I2+O2,当E中出现现象时,可知D中反应完全。从安全、环保角度看,上述装置不足之处是____________。
(6)若D中生成碘12.7mg,则理论上应吸收O3_______mg(O3、I2的相对分子质量分别为48.254)。
探究三·影响臭氧分解的因素
O3在水中易分解,一定条件下,某浓度的O3在浓度减少一半所需的时间(t)如下表所示。
温度 分钟 pH | 3.0 | 4.0 | 5.0 | 6.0 |
20 | 301 | 231 | 169 | 58 |
30 | 158 | 108 | 48 | 15 |
40 | 31 | 26 | 15 | 7 |
(7)①分析表中数据,臭氧的分解速率与___________、___________有关。
②据表推测O3在下列条件下分解速率从小到大的顺序为___________(填序号)。
a.20℃、pH=3.0 b.30℃、pH=4.0 c.50℃、pH=6.0
③臭氧在水中分解是臭氧与水反应生成氧气和过氧化氢,反应的化学方程式为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com