
科目: 来源: 题型:
【题目】(8分)在日常生活中,我们发现切过咸菜的刀更容易生锈.而除锈用稀盐酸比稀硫酸快。为了进一步验证上述现象,某校师生做了以下相关分组实验,请你根据自己平时课堂学习的体验一起参与讨论并回答相关问题。
【步骤一】未打磨的铝片浸入氯化铜溶液中,迅速产生大量气泡和疏松的紫红色固体,并放热,片刻后溶液由蓝绿色变成无色。
(1)若要正视紫红色固体中是否含有氧化铜,可用 ▲ 溶液(填一试剂)加以检验。
【步骤二】未打磨的铝片浸入硫酸铜溶液中,一段时间内没有明显现象。
(2)比较步骤一、二,你能得出的结论是: ▲ 。
【步骤三】打磨过的铝片浸入硫酸铜溶液中,其操作、现象和结论见下表。
(3)试将“影响因素”选项前恰当的字母序号填入答题卡指定位置。
实验操作 | 使用现象 | 对比结论 |
Ⅰ.一片用粗砂纸单向用力打磨3次,将其浸入硫酸铜溶液,片刻后用镊子取出。 | 现象一:粗砂纸打磨的在划痕处有少量气泡,附着少量疏松的紫红色固体。 | 现象一与现象二对比,说明 ① ▲ |
现象二:粗砂纸打磨的片刻内现象不明显。 | ||
Ⅱ.一片用特细砂纸往复打磨数次,再将其浸入硫酸铜溶液,片刻后取出。 | 现象三:特细砂纸打磨的表面产生较多细小气泡,表面均匀附着紫红色固体。 | 现象三与现象一对比,说明 ② ▲ |
现象四:特细砂纸打磨的表面一段时间内没有明显现象。 | 现象四与现象三对比,说明 ③ ▲ |
★影响因素:
A.打磨时用力程度及均匀程度不同
B.选用砂纸颗粒粗细程度不同
C.由于摩擦生热又形成了新的氧化膜
(4)比较步骤三各实验操作中用砂纸打磨的作用是: ▲ 。
(5)请仔细观察下图:

试从微观粒子变化的角度分析该反应的实质是:
▲ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列实验装置图,回答有关问题。

(1)写出有关标号仪器的名称a_____________。
(2)实验室如用A装置制取氧气,反应的化学方程式为________________________。
(3)实验室制取CO2的化学方程式为___________________ ,若要获得干燥的二氧化碳,除发生装置外,还应选用D装置,并在该装置中盛放____________(填写试剂名称)。
(4)实验室若用块状固体和液体在无需加热的情况下制取气体,可将B装置改进为E装置,其改进后的优点是________________,下列反应适用于该装置的是______________(填序号)。
①大理石和稀盐酸 ②碳酸钠粉末与稀硫酸
③锌粒与稀硫酸 ④过氧化氢溶液与二氧化锰
(5)已知:a.相同状况下,气体的相对分子质量越大,密度越大。b.二氧化氮(NO2)是一种红棕色、有刺激性气味的有毒气体,易溶于水。若用排空气法收集NO2,选择上图E装置,气体应从导管口__(填“b”或“c”)端通入。尾气必须要进行吸收处理,其目的是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列反应事实写出相应的化学方程式。
(1)实验室用锌和稀硫酸反应制取氢气,同时生成硫酸锌: __________________。
(2)木炭不完全燃烧生成一种有毒气体: _____________________________。
(3)少量FeCl3溶液滴入NaOH稀溶液中生成Fe(OH)3沉淀和NaCl溶液: __________________。
(4)用一氧化碳和磁铁矿(主要成分为Fe3O4)高温炼铁: ___________________。
(5)碱式碳酸铜受热分解生成三种氧化物: ______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)改善空气质量、保护水土资源是实现美丽中国的基础。
①下列气体的排放会导致酸雨形成的是________(填字母,下同)。
a.CH4 b.CO c.SO2
②下列处理废水的方法利用了中和反应的是________。
a用熟石灰处理废水中的酸
b用活性炭吸附废水中的色素
c用铁粉回收废水中的铜
③下列做法会造成土壤重金属污染的是________。
a.作物秸杆露天焚烧
b.废干电池就地填埋
c.废旧塑料随意丢弃
(2)新鲜牛肉含蛋白质、脂肪、糖类、维生素、钙、铁等,其中:
①属于人体所需微量元素的是____________。
②可为人体提供能量的是____________、____________和____________。
③水果、蔬菜中也含有丰富的维生素,生活中常用稀碱性溶液或清水浸泡,可使残留在蔬菜上的农药降低毒性。如用碱性溶液浸泡蔬菜,可在水中加入适量的____________ 。
a.食醋 b.白糖 c.小苏打
(3)材料的发展与应用促进了人类社会的进步。碳晶地暖环保、节能、安全,其构造如图所示。

其中属于金属材料的是___________;属于高分子材料的是挤塑板和_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Si是重要的半导体材料,半导体工业中有一句行话“从沙滩到用户”,指的是利用沙子(主要成分SiO2)制取高纯度的Si。已知硅与碳有相似的化学性质,SiHCl3(三氯氢硅)能与水反应,其工艺流程和主要化学反应如下:

①2C+SiO2![]() Si(不纯)+2CO↑ ②3HCl+Si(不纯)
Si(不纯)+2CO↑ ②3HCl+Si(不纯)![]() SiHCl3+H2
SiHCl3+H2
③SiHCl3+H2![]() 3HCl+Si(高纯)
3HCl+Si(高纯)
下列说法不正确的是
A. ①的目的是将二氧化硅转化为单质硅 B. 物质A可循环利用
C. ①反应为置换反应 D. Si的沸点低
查看答案和解析>>
科目: 来源: 题型:
【题目】苏州盛产杨梅。杨梅中含有丰富的叶酸,对防癌抗癌有积极作用,其化学式为Cl9Hl9N7O6。下列有关叶酸的说法中正确的是
A.叶酸的相对分子质量为441 g
B.叶酸中氮元素的质量分数大于氧元素的质量分数
C.叶酸中碳、氢、氮、氧四种元素质量比为19:19:7:6
D.叶酸由19个碳原子、19个氢原子、7个氮原子和6个氧原子构成
查看答案和解析>>
科目: 来源: 题型:
【题目】兴趣小组的同学学习了金属的性质后,为了验证金属活动性顺序表中有关结论,在实验室做如下探究:
(实验)
甲同学将一根用砂纸打磨过的光亮的铁丝投入硫酸铜溶液中;
乙同学将一小块钠投入硫酸铜溶液中;
丙同学将一根用砂纸打磨过的光亮的镁条投入一定量的稀HC1中。
(1).甲同学探究中,预期的现象①___________,发生反应的化学方程式是②________。
(2).乙同学的探究中,与预期的现象有很大不同,看到钠与水激烈反应,在水面迅速旋转,并放出大量的热,融化成小球,产生大量无色气体,随后产生蓝色沉淀中,伴有黑色固体。这一特殊现象引起了同学们的探究热情,于是他们查阅资料。
(资料信息)
Ⅰ.钠化学性质很活泼,能置换出水中的氢元素,和另一种物质,并放出大量的热。
Ⅱ.氢氧化铜受热会分解产生两种氧化物。
根据以上信息完成以下问题:
请你写钠与水反应的化学方程式①_________,产生黑色固体的化学方程式②____________。
(3).丙同学的探究中,产生大量气泡后,出现灰白色固体。小组同学对该现象作如下探究。产生气泡反应的化学方程式____________________。
(4).过滤、洗涤、一定温度下烘干丙同学实验中产生的灰白色固体。对灰白色固体作如下猜测并进行实验:
(猜测)
灰白色固体可能是:①剩余的Mg;②MgC12晶体;③ Mg和MgCl2晶体。
(实验)
(1)取灰白色固体样品,加入稀HCl,无气泡产生,则猜测___________(选填序号)不成立。
(2)称取等质量的灰白色固体和MgCl2晶体分别放入同温、等量水中,灰白色固体不溶解而MgCl2晶体全部______________,则猜测②不成立。
(查阅资料):
Mg与MgCl2饱和溶液反应可生成灰白色碱式氯化镁[ Mgx ( OH )yClz],其不溶于水,能与酸反应。
(3)取一定量的灰白色固体,溶于稀硝酸,将所得溶液分成两等份。

①证明AgNO3溶液是否过量的方法::静置,向上层清液中滴加____________。
②通过有关计算求碱式氯化镁[ Mgx ( OH )yClz]中X与Z的比值_________(写出计算过程)
③所得碱式氯化镁的化学式为___________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,工艺流程如下

氯化铵和硫酸钠的溶解度随温度变化如图所示。回答下列问题:

(1) 硫酸钠中硫元素的化合价为____________。
(2)实验室进行蒸发浓缩用到的主要仪器有____、铁架台、玻璃棒、酒精灯等,其中玻璃棒的作用是____。
(3)冷却结晶”过程中析出NH4Cl晶体的合适温度为_______________。
(4)检验NH4Cl产品已洗净的方法是__________________(写出操作、现象、结论)。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学离不开实验,以下是实验室部分仪器或装置如图所示,请回答下列问题:

(1)B仪器的名称是_________________。
(2)若要组装一套制二氧化碳的发生装置,可选择图中的_____________(填仪器下方的字母,下同),写出实验室制取二氧化碳的化学方程式_______,选择F收集二氧化碳导管要插到集气瓶底部的原因是___。
(3)若用高锰酸钾制取氧气,除需增加酒精灯外,还需要的实验用品是_______。写出用高锰酸钾制取氧气的化学方程式__________,用图H所示装置收集氧气,氧气应从_______(填“a”或“b”)端导入。
(4)碘化钾(KI)是白色固体,保存不当会被氧化为单质碘(I2)而泛黄变质。化学小组查得以下资料:Ⅰ. 对于碘化钾变质的原理,有两种不同的反应:
甲:4KI+O2+2CO2=2K2CO3+2I2;乙:4KI+O2+2H2O=4KOH+2I2;
Ⅱ. KOH与NaOH的化学性质相似。为探究碘化钾变质原理的合理性,开展以下实验。
(实验过程)
[实验1] 取适量碘化钾固体暴露于空气中一段时间,观察到固体泛黄,把泛黄的固体中加入足量稀硫酸,产生无色无味的气体并通入澄清石灰水中,澄清石灰水变浑浊。
①石灰水变浑浊的原因是__________________________(用化学方程式表示)。
②化学小组认为:据此现象还不能得出“反应甲是造成碘化钾变质的原因”的结论。理由是__________。


[实验2] 按上图左边所示装置进行实验,数日后,观察到碘化钾固体无泛黄现象。
③据此现象可得出结论是_______________。
[实验3]按上图右边所示装置进行实验,观察到碘化钾固体无泛黄现象。查阅文献获知,常温下某些气体和固体反应需在潮湿环境中进行,化学小组据此改进实验,很快观察到固体泛黄的现象。④简述化学小组改措施:_______________。
(实验结论)⑤根据上述实验,化学小组得出结论:碘化钾固体泛黄变质,是碘化钾与___________共同作用的结果。
查看答案和解析>>
科目: 来源: 题型:
【题目】六月杨梅成熟的季节,九年级的几个同学结伴到马山小天家去摘杨梅和进行野炊活动。
(1)小军上网查阅了有关杨梅中的营养成分的信息

(如图)①其中是人体主要供能物质的是_______(填基本营养素名称)。
②其中属于人体必需的微量元素是_____(填元素符号)。
③他们发现杨梅园旁边的菜园里的部分青菜叶色发黄,都认为应该向菜里施用的是_________(填字母)。
A.K2SO4 B.CO(NH2)2 C.HNO3 D.Ca(H2PO4)2
④小美利用______________检验出小天家的井水是硬水。
(2)他们发现通往小天家的路旁树立着如图所示的太阳能路灯,采用新型太阳能电池的路灯将极大提高能量转换效率。
①右图所标物质中属于有机合成材料的是______________。
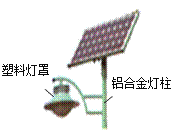
②铝具有很好的抗腐蚀性能,原因是__________________(用化学方程式表示);灯柱材料使用的铝合金属于_________ (填“纯净物”或“混合物”)。
③太阳能电池板的主要材料是硅,硅原子结构示意图为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com