
科目: 来源: 题型:
【题目】纳米材料常常具有一些特殊性质,纳米铁粉在隐形材料喷涂方面有着球形铁粉无可比拟的优越性,广泛用于国防军工领域,某化学小组通过动手实验制备纳米铁粉。
(查阅资料)
(1)用硫酸亚铁、草酸(H2C2O4)两溶液发生复分解反应来制备草酸亚铁(FeC2O4)。
常温下,草酸亚铁的溶解度较小。
(2)焙烧草酸亚铁: FeC2O4 ![]() Fe+2CO2↑。
Fe+2CO2↑。
(3)纳米铁粉在空气容易被氧化生成氧化铁。
(实验步骤)
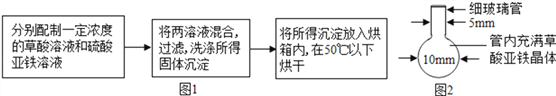
(1)草酸亚铁晶体的制备如图1
①若配制的硫酸亚铁溶液略呈黄色,可能原因是___________________;
②写出硫酸亚铁与草酸溶液反应的化学方程式_________________;
③为了分离所得固体沉淀物,需要的玻璃仪器有烧杯、玻璃棒_______;
④用冰水洗涤固体沉淀物到 pH =7为止的目的是_________________;
(2)纳米铁粉的制备如图2
将一根玻璃管在酒精喷灯上烧制成如图2所示形状,向其中加入黄色草酸亚铁晶体.当草酸亚铁粉末受热完全变黑,立即将管口部分放在火焰烧熔封闭,这样便得到了高纯度的纳米铁粉。
①分解草酸亚铁的实验中所产生的CO2对于该实验步骤所起的作用是________。
②指导老师提醒同学们应准确把握玻璃管的烧熔封闭时间.你认为烧熔过早、过晚的后果分别是______________________,___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是某化学反应的微观示意图,图中不同的圆球代表不同的原子。下列叙述正确的是( )
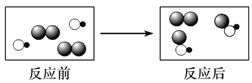
A. 该反应的生成物有2种
B. 该反应的基本类型是化合反应
C. 反应前后分子种类和原子种类均不变
D. 参加反应的两种物质的分子个数比为1∶1
查看答案和解析>>
科目: 来源: 题型:
【题目】工业废料石膏(CaSO42H2O)可以“变废为宝”,用于生产氧化钙、硫酸钾、电石(化学名称为碳化钙)等。某研究性学习小组展开了如下系列研究。
一、高纯CaO的制备
【资料一】
Ⅰ.石膏(CaSO42H2O)与碳粉高温煅烧生成氧化钙和几种气态非金属氧化物。
Ⅱ.SO2能使品红溶液褪色,也能使澄清石灰水变浑浊。
甲同学用如图1装置制备CaO并验证石膏与焦炭高温反应的其他产物。
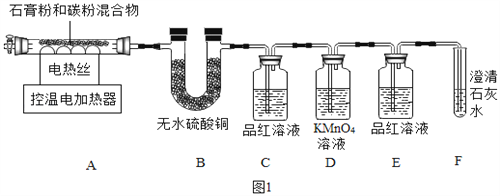
实验过程中发现:B中无水硫酸铜变蓝;C中产生__现象证明有SO2生成;装置__中无明显变化和装置F中__现象证明有CO2生成。写出石膏与碳粉在高温条件下反应的化学方程式:____。
二、硫酸钾和电石的制备
乙同学模拟生产化肥硫酸钾和电石的流程如图2:
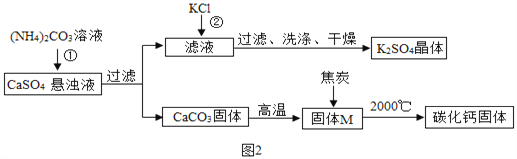
【资料二】CaO与C在高温下反应生成碳化钙(化学式为CaCx)和CO。
(1)反应①的化学方程式为___。证明固体M中不含CaCO3的方法是____(写出实验的方法、现象)。
(2)反应②的化学方程式为(NH4)2SO4+2KCl═K2SO4↓+2NH4Cl,该反应能析出K2SO4晶体的原因是__。
三、假设上述流程中制得的碳化钙(化学式为CaCx)固体中只含杂质CaO,乙小组同学为测定CaCx中x的值进行如下实验。
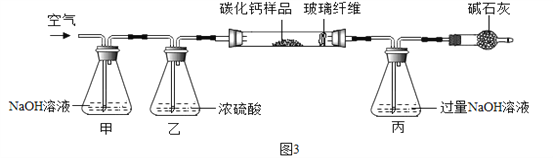
【资料三】CaCx在空气中灼烧生成CaO和CO2。
步骤一:称取3.76g样品于图3所示石英管中(测定装置图如图3,夹持及加热装置省略),反应前缓缓通入空气,高温灼烧石英管中的样品至反应完全后继续缓缓通入空气,测得丙溶液的质量比反应前增重了4.4g。(玻璃纤维可防止固体粉末进入导管)
步骤二:将石英管内剩余固体全部转移到水中,加入足量碳酸钠溶液,经搅拌、过滤、洗涤、干燥等操作得到碳酸钙固体6克。试回答下列问题:
(1)装置甲的作用是__。反应完全后继续缓缓通入空气的目的是__。
(2)根据步骤一、二计算该样品中钙、碳、氧的质量比为___,
计算确定CaCx的化学式(请写出计算过程)______________。
(3)若碳酸钙未能完全干燥,则会导致CaCX中的x的值____(填“偏大”、“偏小”、“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
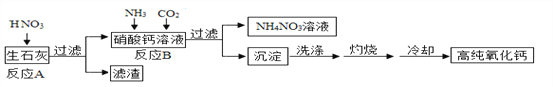
【题目】高纯氧化钙是用于电子工业的重要无机化工原料,用生石灰(主要成分为CaO)制备高纯氧化钙的工艺流程如下:
请回答下列问题:
(1)过滤操作中玻璃棒的作用是_______________;
(2)反应B的化学方程式为________________________;
(3)灼烧时发生反应的化学方程式为_________,该工艺流程中可循环使用的物质是_________;
(4)冷却需在密闭和干燥的环境中进行,否则制得的高纯氧化钙中会混有的两种杂质名称分别是___________和__________。
查看答案和解析>>
科目: 来源: 题型:
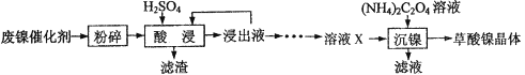
【题目】草酸镍晶体(NiC2O4·2H2O)可用于制镍催化剂。某小组用废镍催化剂(成分为Fe2O3、Ni、Fe、SiO2等)制备草酸镍晶体的部分实验流程如下:
已知:①Ni能和稀H2SO4反应。
②相关金属离子生成氢氧化物沉淀的pH如下表:
金属离子 | 开始沉淀的pH | 完全沉淀的pH |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Ni2+ | 6.7 | 9.5 |
③H2O2能将Fe2+氧化为Fe3+
(1)废镍催化剂“粉碎”的目的是______。
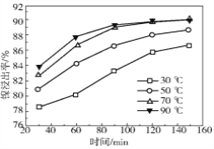
(2)保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化如图,“酸浸”的适宜温度与时间分别为 _______(填字母)。
A.30℃、30min B.90℃、150min C.70℃、120min D.90℃、120min
(3)“酸浸”中发生的复分解反应方程式为________。
(4)“浸出液”得到“溶液x”过程中,加入试剂先后顺序是_____(填字母)。
A.先加H2O2溶液,再加NaOH溶液 B.先加NaOH溶液,再加H2O2溶液
加NaOH溶液调节pH_____(填范围),充分反应后得到滤渣的操作是______,该操作中所用到的玻璃仪器有玻璃棒、烧杯和_________。
(5)将“沉镍”工序:①主要过程为:蒸发浓缩、_____ 、过滤,所得固体用75%乙醇洗涤、110℃下烘干,得草酸镍晶体。
②用75%乙醇洗涤的目的是洗去杂质、___________;
③烘干温度不超过110℃的原因是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生活密切相关
(1)改善空气质量、保护水土资源是实现美丽中国的基础。
①下列气体的排放会导致形成酸雨的是______(填字母序号,下同)。
a.CH4 b.SO2 c.CO2 d.NO2
②下列处理方法属于中和反应的是_______。
a.用氨水处理废水中的硫酸 b. 用小苏打治疗胃酸过多
c.用铁粉从废水中的硫酸铜中回收铜 d.用硫酸铜和熟石灰配制波尔多液
③下列做法会造成土壤重金属污染的是_______。
a.作物秸杆露天焚烧 b. 废旧电池就地填埋
c.废旧塑料随意丢弃 d. 生活污水任意排放
(2)改善生活水平、提高生活质量是实现美丽中国的保障。
①下列食物中富含淀粉的是______(填字母序号);

②饼干中常添加碳酸钙,目的是补充钙元素,可以预防____(填字母序号);
a.甲状腺疾病 b.贫血病 c.骨质疏松,佝偻病 d.智力低下,侏儒症
③材料的发展与应用促进了人类社会的进步。碳晶地暖环保、节能、安全,其构造如图所示。
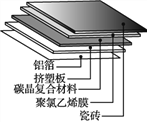
其中属于金属材料的是______;属于有机高分子合成材料的是挤塑板和_______。
④为减轻大气污染,我市已经在主城区禁止燃放烟花爆竹。“禁止燃放烟花爆竹”的标识是______(填字母)。
(3)创新发展材料技术科推动人类社会的进步。
①石墨烯(见下图)可用作太阳能电池的电极,这里主要利用了石墨烯的_________性。

②LiMn2O4是锂离子电池的一种正极材料,可通过MnO2与Li2CO3煅烧制备,同时还生成CO2和一种单质。写出该反应的化学方程式:_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学用语是学习化学的重要工具。
(1)用化学符号表示:
①2个铁原子__________; ②3个二氧化硫分子________;③氯酸钾中氯元素的化合价________; ④镁离子__________。
(2)用字母序号填空:a.活性炭 b.生石灰 c.干冰 d.葡萄糖
①可用于人工降雨的是_______; ②可直接进入血液补充能量的是___;③可以用来吸附色素等物质的是_______;④可用食品干燥剂的是___________。
(3)写出下列反应的化学方程式:
①红磷在空气中燃烧_________; ②氯化钡溶液与硫酸钠溶液反应_________;③用少量稀盐酸除去铁器表面的“锈迹”__________;④电解饱和食盐水制烧碱,同时生成氢气和氯气(Cl2)_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化碳是实验室经常制备的一种气体,通常用向上排空气法收集,那么,二氧化碳能否用排水法收集?某小组同学对该气体做了如下探究:
资料:通常状况下,1 体积水约能溶解1体积二氧化碳,所得溶液的pH约为5.6;
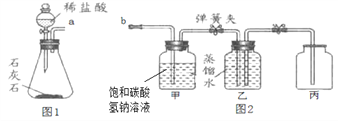
【设计实验】
(1)实验一:图1中滴加稀盐酸的仪器名称为______ ,反应的化学方程式_______。
待生成的二氧化碳将锥形瓶中空气排尽时,连接a和b。检验锥形瓶中的空气已排尽的方法是___。
(2)实验二:待乙瓶中收集半瓶气体时,停止通入二氧化碳,关闭乙瓶左、右的弹簧夹;测得丙瓶中溶液的pH=6.5;充分震荡乙瓶后,测得其溶液的pH=5.6。分析可知,丙瓶中所溶解二氧化碳的体积______(填“大于”、“小于”或“等于”)乙瓶中液体的体积。实验中,甲瓶中饱和碳酸氢钠溶液的作用是________,若没有该装置,则乙瓶中测出的溶液pH 会______(填“偏大”、“偏小”或“不影响”)。
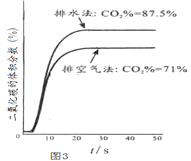
(3)实验三:图3是用二氧化碳检测仪测得的排空气法和排水法收集的气体中二氧化碳体积分数随时间的变化曲线关系图,由实验一、二、三分析,你认为二氧化碳____(填“能”或“不能”)用排水法收集。用排水法收集二氧化碳时,能减少二氧化碳在水中溶解能力的措施是____。(写一条即可)
查看答案和解析>>
科目: 来源: 题型:
【题目】空气和水是重要的自然资源。
(1)下列物质不属于空气污染物的是_____,能形成硫酸型酸雨的是______。
A.CO2 B.SO2 C.NOX D.CO
(2)下列能溶于水形成溶液的是______,溶于水pH>7的是______。
A.食用油 B.面粉 C.蔗糖 D.纯碱
(3)如图是实验室电解水实验的装置图,a试管中产生的气体为_____,水中加入少量氢氧化钠的目的是_______。
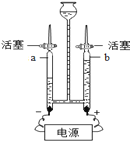
(4)生活中,常用____鉴别硬水和软水。
(5)水常用于灭火,其灭火主要原理是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】肼(N2H4)是氮和氢形成的化合物,易溶于水。工业上利用尿素法生产肼,同时得副产品十水碳酸钠,工艺流程如下:
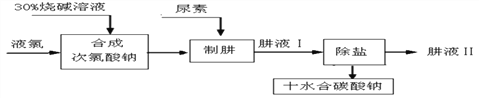
(资料)①尿素的化学式为CO(NH2)2; ②Cl2+H2O==HCl+HClO;
③制肼过程的反应为CO(NH2)2+NaClO+2NaOH==N2H4+Na2CO3+NaCl+H2O;
下列说法不正确的是
A. 尿素不能与熟石灰、草木灰等碱性物质混合使用,会生成氨气,造成肥效流失
B. Cl2与NaOH溶液发生反应的化学方程式为Cl2+2NaOH==NaCl+NaClO+H2O
C. 从母液中分离出十水合碳酸钠晶体,可采用蒸发浓缩、冷却结晶、过滤、洗涤干燥等步骤
D. 从后续反应过程来看,若要使原料利用率最佳,合成次氯酸钠时投入的液氯与烧碱的质量之比为71 :80
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com