
科目: 来源: 题型:
【题目】下图中 A﹣L 是初中化学常见的物质。按单质、氧化 物、酸、碱、盐分类,A、B、C、D、E 是五种不同类别的物 质,F 是大理石的主要成分。I 可用于配制农药波尔多液且溶液为 蓝色,K 是红棕色固体。图中“—”表示相连的两种物质之间可 以发生反应,“→”表示物质间存在着相应的转化关系(部分反应 物、生成物及反应条件已略去).
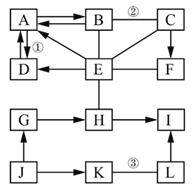
请回答:
(1)写出化学式 F_______ ,G_______ 。
(2)写出反应的化学方程式
②______;③______
(3)反应①的基本反应类型是_______ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】兴趣小组的同学对碳酸氢钠、碳酸钠、氢氧化钠的某些性质进行相关探究.
【提出问题】它们溶液的酸碱性及与酸反应时溶液的pH如何变化?
【实验探究1】向等体积、等浓度的碳酸氢钠、碳酸钠、氢氧化钠溶液中,分别加入几滴紫甘蓝汁液,同时用蒸馏水进行对比实验,观察并记录现象如下:
液体名称 | 蒸馏水 | 碳酸氢钠溶液 | 碳酸钠溶液 | 氢氧化钠溶液 |
紫甘蓝汁液显示的颜色 | 蓝紫色 | 蓝色 | 绿色 | 黄色 |
查阅资料:
pH | 7.5~9 | 10~11.9 | 12~14 |
紫甘蓝汁液显示的颜色 | 蓝色 | 绿色 | 黄色 |
【得出结论1】三种溶液的碱性由强到弱的顺序为_____.
【实验探究2】甲同学在烧杯溶液中加入约5mL稀氢氧化钠溶液,滴入几滴酚酞溶液,此时溶液由_____色变为_____色.向其中加入稀盐酸,该反应的化学方程式为_____.
乙同学向一定体积、一定浓度的氢氧化钠溶液中,逐滴加入一定浓度的盐酸,得到pH变化与时间的关系如图1所示.
【得出结论2】从微观角度分析,该反应的实质是__________.
【实验探究3】向等体积、含等碳原子数的碳酸氢钠和碳酸钠溶液中,分别逐滴加入一定浓度的盐酸,得列pH变化与时间的关系如图2、图3所示.
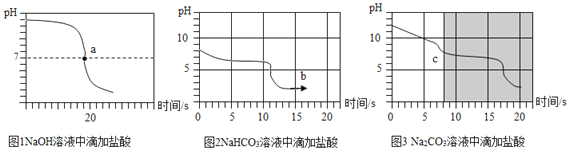
【交流与反思】b点的溶质为_____(写化学式),将图2和图3的阴影部分进行叠加,发现两者基本重合,c点的溶质_____(写化学式)
【得出结论3】通过上述分析,碳酸钠和盐酸反应过程,可以依次用以下两个化学方程式表示:_____________、____________.
【结论与反思】探究溶液的酸碱性及反应pH值的变化,可以认识反应的原理及进行的过程.
查看答案和解析>>
科目: 来源: 题型:
【题目】水与人类的生活和生产密切相关。
(1)我国药学家屠呦呦因研制新型抗疟药青蒿素和双氢青蒿素而获得了诺贝尔奖。东晋名 医葛洪《肘后备急方》中就有青蒿素抗疟的记载:“青蒿一握,以水二升渍,绞取汁,尽服之”。这里的“水”作_____。上述水煎青蒿治疗疟疾,药性很不稳定,效果很差,屠呦呦改用乙醇提取,控温 60℃,药性显著提高,说明青蒿素具有的性质是(答一条):_____ 。
(2)利用下图甲所示装置净化河水,下列说法错误的是_____
A.活性炭层可除去异味和色素 B.此净化水的过程主要发生的是物理变化
C.此装置可以将硬水软化 D.利用此装置净化得到的水不宜直接饮用

(3)电解一定量的水(如上图乙),当负极端产生 10mL 气体时, 理论上在正极端产生气体的体积为_____mL。
(4)能说明水是由氢元素和氧元素组成的实验是_____(填序号)
A.氢气在氧气中的燃烧 B.氢气在氯气中的燃烧
C.水的净化 D.水的电解
(5)下图是 a、b、c 三种固体物质的溶解度曲线

①t2℃时,将等质量的 a、b 两种物质加水溶解配制成饱和溶液,所 得溶液质量的大小关系为:a_____b(填“>”、“<”或“=”)。
②t1℃时,将 60g 物质 a 的饱和溶液升温至 t2℃(溶剂量不变),至 少需要加入______g 物质 a 才能重新达到饱和状态。
③将 t2℃时 a、b、c 三种物质的饱和溶液降温至 t1℃,溶液中溶质 质量分数的大小关系是_____。
(6)若要配制 245g 溶质质量分数为 10%的稀硫酸,需要溶质质量 分数为 98%的浓硫酸(密度为 1.84g/cm3)_____mL(计算结果
保留一位小数)。实验室用浓硫酸配制稀硫酸的主要步骤有:计算、_____、混匀、 冷却至室温装瓶并贴上标签。
查看答案和解析>>
科目: 来源: 题型:
【题目】某气体由 CH4、C2H2、C2H4 中的一种或几种组成,取该气体样品在氧气中完全燃烧,测 得生成的二氧化碳和水的质量比为 22:9,下列对该气体组成的判断正确的是
A. 该气体中一定含有 C2H4
B. 该气体中可能含有 CH4
C. 该气体中一定没有 C2H2
D. 该气体不可能同时含有 CH4、C2H2、C2H4
查看答案和解析>>
科目: 来源: 题型:
【题目】实验小组用如图装置测定空气中的氧气含量。锥形瓶中空气的体积为 100mL。注射器中水的体积为 25mL,装置气密性良好。下列说法不正确的是

A. 气球的作用是缓冲装置中的压强变化
B. 红磷熄灭后应该等装置冷却到室温,再打开弹簧夹观察现象
C. 打开弹簧夹后,注射器中的水一定会全部进入锥形瓶中
D. 锥形瓶底的细沙可以防止红磷燃烧时造成瓶底炸裂
查看答案和解析>>
科目: 来源: 题型:
【题目】硼(B)及其化合物在工业上有许多用途。以铁硼矿(主要成分为Mg2B2O5·H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和难溶性SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示:

已知:①Mg2B2O5·H2O+2H2SO4![]() 2MgSO4+2H3BO3②CaSO4微溶于水
2MgSO4+2H3BO3②CaSO4微溶于水
③H2O2溶液可将Fe2+氧化为Fe3+④Fe3+、Fe2+、Al3+以氢氧化物形式开始沉淀和完全沉淀时的pH如下表:
开始沉淀 | 完全沉淀 | |
Fe3+ | 1.14 | 3.0 |
Fe2+ | 5.85 | 8.35 |
Al3+ | 3.0 | 4.7 |
请回答下列问题:
(1)利用______(填物质名称)的磁性,可将该物质直接从“铁硼矿粉”中分离。
(2)酸浸时,矿粉中的金属氧化物会和酸反应,试写出Fe2O3酸浸时的化学反应方程式__________。
(3)为了提高浸出速率(即加快反应速率),除适当增加硫酸浓度外,还可采取的措施有______(写出一条)。
(4)操作a为______,“浸渣”中含有CaSO4和______(填物质化学式)。
(5)“净化除杂”需先加H2O2溶液,然后再调节溶液的pH约为5,目的是_____。
(6)制得的粗硼酸中的主要杂质为________________(填物质化学式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】我国自主研制的喷气式大型客机 C919 在制造过程中使用了大量的铝锂合金。已知锂元 素在周期表中的相关信息(1 个碳 12 原子的质量约为 1.99×10-26kg),下列说法正确的是

A. 锂元素的相对原子质量为 6.94g
B. 1 个锂原子的质量约为 1.38×10-25kg
C. LiAlH4 中 Li 元素的质量分数约为 18.3%
D. 锂铝合金的硬度比金属铝的硬度小
查看答案和解析>>
科目: 来源: 题型:
【题目】2018 年 4 月 7 日为“世界卫生日”,其主题是“从农场到餐桌,食品安全人人有责”。专家提醒:烧烤摊里会吃出“癌症风险”,腌制的肉串会产生一种叫做二甲基亚 硝胺(C2H6N2O)的强致癌物质。请回答下列问题:
(1)二甲基亚硝胺含有_____种元素;1 个二甲基亚硝胺分子由_____个原子构 成。
(2)该物质中碳元素与氮元素的质量比_____(填最简整数比)。
(3)3.7g 该物质中氮元素的质量为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】金属在日常生活,工农业生产和科学研究方面应用广泛。
(1)铜可用来制作导线,是因为其具有良好的延展性和__________。
(2)在空气中,铝表面生成一层致密的氧化膜,氧化膜的主要成分是_________。
(3)我国古代掌握了多种金属冶炼技术。春秋时期,发明了冶铁技术,其方法是将赤铁矿(主要成分为Fe2O3)与木炭交错堆积,利用自然风力进行燃烧,木炭不完全燃烧产生的CO将矿石中的Fe2O3还原成铁, 下图为铁制品循环利用的示意图
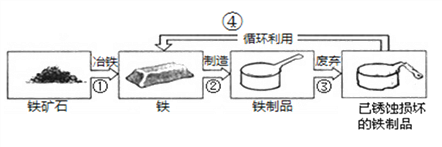
从“①”、“②”、“③”、“④”中,选出一定发生化学变化的是__________(填序号)不能用铁制容器盛放硫酸铜溶液的原因是______________________(用化学方程式表示)废旧金属“循环利用”的意义是_______________________(写一点即可)
(4)2015年,海昏侯墓出土了大量的青铜器,其表面有绿色的铜锈,其主要成分为碱式碳酸铜[Cu2(OH)2CO3]。试推测铜生锈是铜与氧气、水、_______共同作用的结果。
查看答案和解析>>
科目: 来源: 题型:
【题目】完成下列变化的化学方程式,并按要求填空。
(1)镁条在空气中燃烧 _______________,点燃镁条时使用的夹持仪器是________。
(2)实验室用6%的过氧化氢溶液与二氧化锰混合制氧气_____________,6%的过氧化氢溶液中氢元素的质量分数为____________。(计算结果精确到0.1%)
(3)氨水与硫酸反应_______________________,生成的盐可用作________肥(填写化肥种类)。
(4)一氧化碳在高温下与氧化铁反应_______________,反应前后气体的化学计量数之比为_______________。
(5)受到猛烈撞击时,硝酸铵会迅速分解生成一氧化二氮气体和另一种氧化物___________,一氧化二氮中氮元素的化合价为____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com