
科目: 来源: 题型:
【题目】事物之间存在联系,找出联系、发现规律是我们学好化学的一种基本方法。
(1)结构决定性质。研究发现含有“过氧基(—O—O—)”的物质具有很强的氧化性,可以作杀菌消毒剂。据此推测,下列物质中,可用作杀菌消毒剂的是 (填数字序号)。
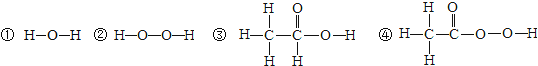
(2)核电荷数为1~18的元素的原子结构示意图等信息如下,回答下列问题:
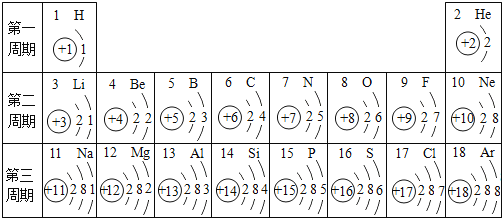
在第3周期中,各原子核外电子排布的变化规律是 。
(3)能将下列物质:“空气、氧气、水蒸气、二氧化碳、高锰酸钾、铁粉、氮气、氧化铁”中的“氧气、铁粉、氮气”分为一类的依据是 。
(4)X元素1个原子的质量是m克,Y元素的相对原子质量为A;化合物XY2的相对分子质量是M,则w克XY2中含有Y的原子数是 。
(5)A、B、C、D、E、F均为初中化学常见的物质,且均含一种地壳中含量最多的元素,其中A是单质;B、C在常温下均为液体,且组成元素相同;E在常温下为气体,有分子构成,能使澄清石灰水变浑浊;反应①中出现火星四射现象。它们之间存在如图所示的转化关系(图中转化条件已略去)。
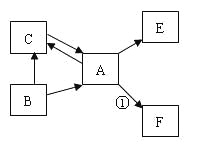
回答有关问题:
①写出B的化学式,并表述显负价元素的化合价: ;
②写出一个属于化合反应的文字表达式或化学方程式 ;
查看答案和解析>>
科目: 来源: 题型:
【题目】填写化学符号或化学符号表示的意义
化学符号 | ____ | _______ |
| NO3- | _______ | ||
表示意义 | 氖气 | 三个铁离子 | _______ | _______ | 2个氮气分子 |
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是某化学反应前后反应物与生成物分子及其数目变化微观示意图,其中不同的圆球代表不同的原子。下列说法错误的是()

A. 该反应可能是氧化反应
B. 该图说明化学反应中分子可以再分,原子不能再分
C. 该反应中,参加反应的两种分子个数比为5:1
D. 反应前后,原子的种类与数目都发生了改变
查看答案和解析>>
科目: 来源: 题型:
【题目】目前全世界的镍(Ni)消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍常用于各种高光泽装饰漆和塑料生产,也常用作催化剂。可以说镍行业发展蕴藏着巨大的潜力。
Ⅰ制备草酸镍
工业上可利用含镍合金废料(除镍外,还含有Fe、Cu、Ca、Mg、C等杂质)制取草酸镍(NiC2O4)。
根据下列工艺流程图回答问题:
【资料卡片1】
(1)过氧化氢(H2O2)俗称双氧水,是一种液体,受热易分解,可用于实验室制取氧气;过氧化氢具有强氧化性,所以常作为氧化剂、漂白剂和消毒剂。
(2)氧化反应可以从元素化合价升降的角度进行分析:物质所含元素化合价升高的反应就是氧化反应。
(3)金属镍的化学性质类似于铁,与盐酸反应能生成氯化镍(NiCl2)。
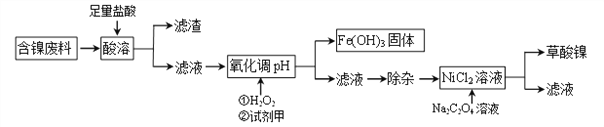
(1)“酸溶”之后的滤渣中含有的金属是_______________。
(2)写出酸溶过程中Ni与盐酸反应的化学方程式_________________________。
(3)加H2O2时,温度不能太高,其原因是_______________________。若H2O2在“酸溶”步骤即与盐酸同时加入,则与原方案相比滤液中会增加的金属离子是Cu2+和_______(写离子符号)。
(4)已知Na2C2O4溶液加入NiCl2溶液发生复分解反应,写出该反应的化学方程式____________。
Ⅱ制备镍粉
工业用电解镍液(主要含NiSO4)制备碱式碳酸镍晶体xNiCO3yNi(OH)2zH2O,并利用其制备镍粉,过程如下:
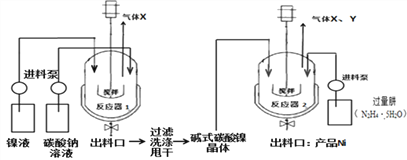
(5)反应器1中的一个重要反应为3NiSO4+3Na2CO3+2H2O ![]() NiCO32Ni(OH)2+3Na2SO4+2X,X的化学式为_________。
NiCO32Ni(OH)2+3Na2SO4+2X,X的化学式为_________。
(6)反应器1的出料口获得的固体洗涤时,需用纯水洗涤,可以用来检验固体已洗涤干净的试剂是____________。
(7)反应器2中产生的气体Y是空气中含量最多的气体,该气体是_________(填名称)。
Ⅲ 测定碱式碳酸镍晶体的组成
为测定碱式碳酸镍晶体【xNiCO3yNi(OH)2zH2O】组成,某小组设计了如下实验方案及装置:
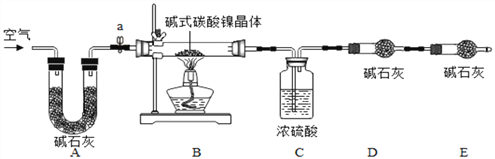
【资料卡片2】
(1)碱式碳酸镍晶体受热会完全分解生成NiO、CO2及H2O
(2)在温度控制不当导致温度过高时,NiO会被氧化成Ni2O3
(3)碱石灰是NaOH及CaO的混合物,可以吸收CO2和H2O
【实验步骤】
①检查装置气密性;②准确称取3.77g碱式碳酸镍晶体【xNiCO3yNi(OH)2zH2O】放在B装置中,连接仪器;③打开弹簧夹a,鼓入一段时间空气,分别称量装置C、D、E的质量;④关闭弹簧夹a,加热装置B至装置C中导管末端无气泡冒出;⑤打开弹簧夹a,缓缓鼓入一段时间空气;⑥分别准确称量装置C、D、E的质量;⑦根据数据进行计算(相关数据如下表)。
装置C/g | 装置D/g | 装置E/g | |
加热前 | 200.00 | 180.00 | 180.00 |
加热后 | 201.08 | 180.44 | 180.00 |
【实验分析及数据处理】
(9)计算3.77g碱式碳酸镍晶体【xNiCO3yNi(OH)2zH2O】中镍元素的质量_________(写出计算过程,计算结果准确到小数点后两位)。
【实验反思】
(10)另一小组同学在实验中发现,实验结束后,称得装置B中残留固体质量明显偏大,老师带领全组同学经过仔细分析后发现,这是由于该组同学加热时在酒精灯上加了铁丝网罩,温度过高所导致。请问该组同学称得的残留固体中镍元素的质量分数可能是__________。
A.70.08% B.75.88% C.78.67% D.79.58%
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化铬晶体(CrCl3·6H2O)是一种重要的工业原料,工业上常用铬酸钠(Na2CrO4)来制备。实验室中则以红矾钠(Na2Cr2O7)为原料制备CrCl3·6H2O,工艺流程如下:
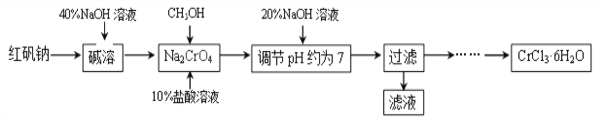
已知:a.CH3OH+10HCl+2Na2CrO4 2CrCl3+4NaCl+CO2 ![]() +7H2O;
+7H2O;
b.Cr(OH)3是一种难溶于水的碱;
c.CrCl3·6H2O不溶于乙醚,易溶于水、乙醇。
(1)在“调节pH约为7”的步骤中,测定溶液的pH可使用____________。请写出该步骤的反应原理_____________(用化学反应方程式表示)。
(2)“碱溶”步骤中所加40%NaOH溶液不宜过量太多的原因是_________________。
(3)请你补充完整由过滤后得到的固体Cr(OH)3制备CrCl3·6H2O的实验方案:将过滤后所得固体溶解于盐酸,通过蒸发浓缩、________、过滤、洗涤、低温干燥,得到CrCl3·6H2O。下列物质中可以用来洗涤CrCl3·6H2O的是_________(填序号)。
A.水 B.盐酸 C.乙醇 D.乙醚
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列装置回答问题。
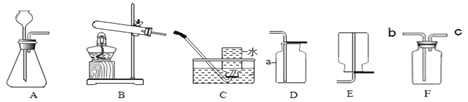
(1)请写标号仪器的名称:a______________。
(2)用高锰酸钾为原料制取较纯净的氧气可选用的装置组合为__________(填字母,下同),发生装置应作的改进是_____________,反应的化学方程式为_________________。
(3)实验室用锌粒和稀硫酸制取氢气,反应的化学方程式为__________________,可选用的发生装置是_______,若用F装置收集氢气,气体应从________端通入(填“b”或“C”)。
(4)已知:氨气极易溶与水,且与水反应生成氨水,氨气难溶于氢氧化钠溶液。
①碳酸氢铵是一种常用的氮肥,受热易分解,生成氨气、水、二氧化碳,该反应的化学方程式为__________。
②检验碳酸氢铵分解后的气体中含有二氧化碳,下列方案可行的是___________(填序号)。
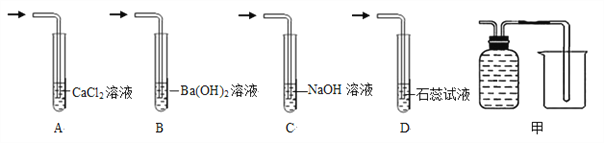
③甲图可用于分离碳酸氢铵分解产生的气体并回收氨气,广口瓶中应盛放的液体是_________,装置需要作怎样的改进才能达到实验目的?请用铅笔在答题卡相应位置画出。 _________________
查看答案和解析>>
科目: 来源: 题型:
【题目】化学使世界变得绚丽多彩。
(1)请从C、H、O、Na、Ca五种元素中选择一种或几种元素,写出符合下列要求的化学用语。
①人体中最多的物质_____________;②一种补钙剂___________;
③炼铁炉中的还原性气体_________;④纯碱中的阴离子________。
(2)下图是某品牌家用燃气灶结构图解:

①图中属于金属材料的有_______(填一种即可)。
②燃气灶所用燃气有煤气、天然气、液化石油气等。天然气属于______(填“可再生”或“不可再生”)能源,写出天然气的主要成分燃烧的化学方程式___________。
③熄灭燃气灶的方法是关闭阀门,其依据的原理是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】有一包粉末,已知由CaCO3、FeCl3、MgCl2、Na2SO4、NaOH、NaNO3中的2种或2种以上物质组成。为了确定其成分,现进行以下实验(假设各步反应已充分):
①取一定质量的粉末,加水搅拌后过滤,得到沉淀甲和无色溶液A;
②向①的沉淀甲中加入足量稀盐酸,得到无色气体和黄色溶液;
③将①得到的无色溶液A进行如图所示的实验。
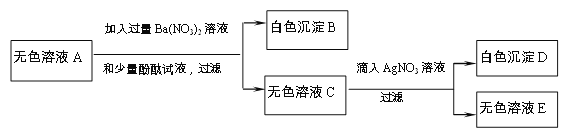
下列说法正确的是:
A. 沉淀甲一定是CaCO3、Fe(OH)3两种物质组成的混合物
B. 无色溶液A中一定存在的溶质是Na2SO4、NaOH
C. 这包粉末中一定含有的物质是CaCO3、FeCl3、MgCl2、Na2SO4、NaOH
D. 这包粉末中可能含有的物质是MgCl2、NaNO3
查看答案和解析>>
科目: 来源: 题型:
【题目】为探究锌、铜、铁三种金属的活动性顺序,小青设计了如图所示实验。待试管中的反应完全停止后,她将试管①、试管②内的物质全部倒入烧杯乙中,充分反应后发现烧杯中的红色固体物质明显增多。下列说法正确的是:
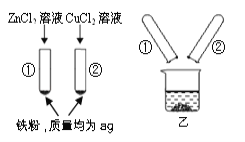
A. 反应后烧杯中的固体一定含有铁
B. 试管②中反应后固体一定含铜,可能含铁
C. 反应后烧杯中的溶液一定不含有氯化铜
D. 烧杯中最后所得固体的质量一定大于2a克
查看答案和解析>>
科目: 来源: 题型:
【题目】a、b、c三种固体物质的溶解度曲线如图所示,下列叙述正确的是
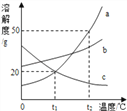
A. a物质的溶解度大于b物质的溶解度
B. a、c两种物质的饱和溶液降温均能析出晶体
C. t2℃时,30ga物质加入50g水中得到80g溶液
D. 将t2℃的a、b、c三种物质的饱和溶液降温到t1℃,所得溶液溶质质量分数的关系为b>a>c
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com