
科目: 来源: 题型:
【题目】A—F为初中化学学习中常见物质,且A、B、C、D中均含有同一种金属元素,物质间转化关系如图所示,下列说法不正确的是
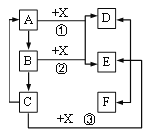
A. 物质X能用于金属除锈
B. 反应②是中和反应
C. 反应①②③都属于复分解反应
D. A、B、E、F一定是氧化物
查看答案和解析>>
科目: 来源: 题型:
【题目】“镉大米”是指大米中镉元素超出了国家食品安全标准。有研究表明,人体摄入镉过量会引发肾功能障碍并导致“痛痛病”、软骨病等。由于水稻生长对土壤中的镉有富集作用,进而导致大米中的镉被人体吸收的概率增加,所以治理土壤中的镉污染刻不容缓。请根据以上信息回答14-16题。
【1】摄入的镉元素主要危害人体中的物质是
A. 蛋白质 B. 淀粉 C. 维生素 D. 油脂
【2】经研究发现长期使用磷肥将增加土壤中的镉含量,以下属于磷肥的是
A. 氯化钾KCl B. 碳酸氢铵NH4HCO3
C. 磷酸二氢钙Ca(H2PO4)2 D. 磷酸二氢铵NH4H2PO4
【3】同时研究表明水稻对镉的吸收率与土壤的pH有紧密关系(如图所示),因此以下物质可用于改良土壤结构,用于降低水稻对镉吸收的有
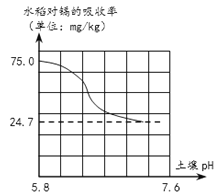
A. 烧碱 B. 熟石灰 C. 汽水 D. 稀盐酸
查看答案和解析>>
科目: 来源: 题型:
【题目】氢氧化钠是一种重要的化工原料,也是实验室中常见的一种试剂,氢氧化钠必须密封保存,因为易与空气中二氧化碳发生化学反应而变质,用化学方程式表示变质原因__________。
下面是几位同学对一瓶氢氧化钠固体成分进行的探究:
探究一:确定一瓶氢氧化钠固体是否变质
小强方案:
实验操作 | 实验现象 | 结论 |
取少量样品于试管中,加入一定量水,样品全溶解后,滴加足量的__________(填一种溶液名称) | 有气泡产生 | ___________ |
探究二:确定氢氧化钠固体变质的程度
小刚方案:
实验操作 | 实验现象 | 结论 |
①取少量样品于试管中,加入一定量水后,样品全溶解后,滴加过量的氯化钙溶液 | 产生白色沉淀 | 氢氧化钠固体部分 变质 |
②静置后取上层清液于试管中,滴入2滴酚酞试液 | _________ |
在上述实验操作中有同学提出可用氢氧化钙溶液代替氯化钙溶液,你认为该方案_____ (填“可行”或“不可行”),理由:________探究三:定量分析部分变质的氢氧化钠固体中氢氧化钠的质量分数
(1)、下面是小明和小军两位同学不同的设计实验方案:
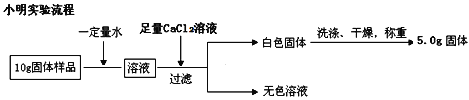
通过小明实验方案计算出样品中氢氧化钠的质量分数________(写出计算过程)
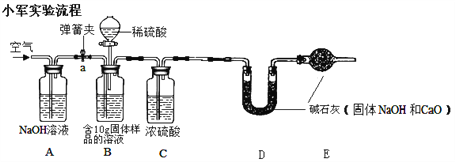
(2)、小军实验步骤如下
①检查好装置气密性,装好药品后连接并固定好装置
②打开弹簧夹a,通入一段时间的空气,再称量D装置质量记录为100g
③关闭弹簧夹a,打开B装置中的分液漏斗,滴入稀硫酸,直到瓶内无气泡产生。
④打开弹簧夹a, 继续通入一段时间空气,再称量D装置质量记录为102.2g
实验分析:
(1)在小军实验中A装置作用是__________
(2)实验步骤④中,继续通入一段时间空气的目的是_________________
(3)如果缺装置C,最终所测得氢氧化钠的含量将会________(填“偏高”、“不变” 、或者“偏低”)
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸铜是一种应用极其广泛的化工原料,易溶于水而不易溶于酒精;铜离子完全沉淀的pH是5左右,铁离子完全沉淀的pH是2左右。以下是某工厂用含铁废铜为原料生产胆矾(CuSO4·5H2O)和副产物石膏(CaSO4·2H2O)的生产流程示意图:

胆矾和石膏在不同温度下的溶解度(g/100g水)如表。
温度(℃) | 20 | 40 | 60 | 80 | 100 |
石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
请回答下列问题:
(1)红褐色滤渣的主要成分是____________;
(2)铜和稀硝酸反应的化学方程式3Cu+8HNO3=_____________+2NO↑+4H2O;
(3)石灰浆调pH大约要调节到___________
A. 2 B. 5 C. 7 D. 10
(4)操作I最后温度应该控制在___________℃左右;
(5)从溶液中分离出硫酸铜晶体的操作Ⅱ应为蒸发浓缩、_______、过滤、洗涤、干燥;晶体用无水乙醇作洗涤液而不用蒸馏水的原因是__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组同学进行如下实验探究。
(一)实验室常用下图装置制取气体
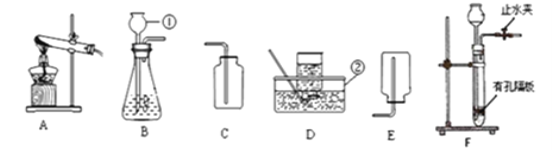
(1)写出图中标示的仪器名称:②_______________。
(2)实验室用氯酸钾和二氧化锰的混合物制取纯净的氧气,可选用的装置组合为____(填字母序号),该反应的化学方程式是______________________。
完全反应后的固体残渣,通过以下四步实验操作可回收得到较纯净的二氧化锰(残渣中只有二氧化锰难于水),正确操作的先后顺序是_______(填写选项符号)。
a.烘干 b.溶解 c.过滤 d.洗涤
(3)在实验室制取氢气的实验装置中,F装置相对于B装置具有的优点是 ____,该反应的化学方程式是____。
(4)实验室用块状石灰石和适量稀盐酸反应至气泡逸出不明显后,测得其残留液pH等于2,此时取适量反应后溶液,逐滴滴入碳酸钠溶液,并用pH数字探测仪连续监测,得曲线如下(pH为纵坐标,时间为横坐标)。
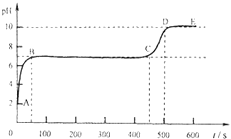
①BC“平台”段的化学方程式是_____________________
②CD段上升的原因是__________________
(二)已知:草酸钠固体(化学式为Na2C2O4)加热分解生成碳酸钠和CO。小陆同学利用该反应制取CO,并用CO还原氧化铁。他设计的实验装置如图:
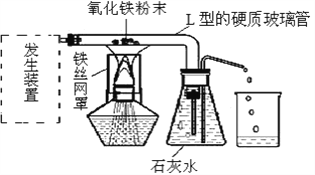
(1)写出制取一氧化碳的化学方程式______________。
(2)L型的硬质玻璃管中的反应现象是______________;
(3)该装置中锥形瓶(足量澄清石灰水)的作用是:
Ⅰ检验并吸收生成的CO2;
Ⅱ____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学就在我们身边,人类的衣、食、住、行都离不开化学。
(1)请运用所学化学知识,帮同学们解决野炊时涉及到的下列问题:

①野炊所带的如下物品中,由金属材料制成的是_________(填标号);
②做饭过程中,小红把捡来的树枝架空,使其燃烧更旺,原理是__________________;
③C如果乱丢弃会导致的环境问题是_________________;
④野炊时,大家用干枯的野草生火,得到了很多草木灰。农村经常使用草木灰作为农家肥料,它的主要成分是一种含钾的盐。取一些草木灰加入盐酸中,生成的气体可使澄清石灰水变浑浊,由此可推断草木灰的主要成分可能是_______(填化学式)。
(2)水和空气是人类赖以生存的自然资源。
①下列有关水和空气的叙述中正确的是________。
A.地球上水的总储量很大,但淡水资源并不充裕
B.充分利用太阳能、氢能等清洁能源可减少酸雨、温室效应等环境问题的发生
C.目前计入空气质量日报的主要污染物中已包括了二氧化碳
D.空气是重要的自然资源,利用其成分可以制造许多产品
②溶解了较多的可溶性钙和镁的化合物的水属于硬水,实验室中一般可用______的方法来降低水的硬度。
③实验室欲将200g质量分数为10%的氯化钠溶液稀释为5%的稀溶液,需加水的质量为______g。
④泡菜具有独特的风味,适合制作泡菜的食盐水浓度是4%。在配制4%的食盐水时,会导致溶液浓度偏小的是_______。
① 称量好的食盐倒入烧杯时,有少许洒出 ② 量水的体积时,俯视量筒
③ 溶解食盐的烧杯内壁是潮湿的 ④ 用4g食盐和100g水配制溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】一包固体粉末可能含有NaNO3、CaCO3、NaOH、CuCl2、NaCl和Ca(NO3)2中的一种或几种,为确定其组成,某同学设计了如下实验方案:
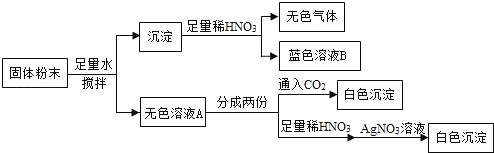
下列判断正确的是( )
A.蓝色溶液B中阳离子只有Cu2+
B.无色溶液A中一定有NaOH
C.原固体粉末一定有NaCl
D.原固体粉末一定有CaCO3、NaOH、NaNO3、CuCl2和Ca(NO3)2
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是A、B、C三种物质的溶解度曲线。下列说法错误的是

A.t2℃时,C物质的饱和溶液能用降温的方法转化为不饱和溶液
B.t1℃时,A、C物质饱和溶液中溶质的质量分数为25%
C.分别将t2℃时A、B、C三种物质的饱和溶液降温至t1℃,此时溶液中溶质的质量分数由大到小的顺序是B>A>C
D.当A中含有少量B时,可用降温结晶的方法提纯A
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室有一部分被氧化成氧化镁的镁粉样品、未知浓度盐酸和40%的氢氧化钠溶液。兴趣小组同学为分析样品中金属镁的质量百分含量和计算盐酸的质量分株,进行如下探究:
(1)用盐酸溶解样品(样品混合均匀),测定生成氢气质量。实验数据如下表所示:
实验序号 | 所取样品质量(g) | 所加盐酸质量(g) | 生成氢气质量(g) |
Ⅰ | 16.0 | 60.0 | 0.5 |
Ⅱ | 16.0 | 130.0 | 1.0 |
Ⅲ | 16.0 | 150.0 | 1.0 |
镁粉样品中金属镁的质量百分含量为_________________。
(2)向实验Ⅲ后的溶液中加入40%的氢氧化钠溶液,生成沉淀的质量随加入氢氧化钠溶液质量的变化关系如图所示。计算盐酸的质量分数。(写出计算过程)
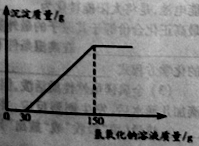
查看答案和解析>>
科目: 来源: 题型:
【题目】锌及其氧化物(ZnO,白色,难溶于水,溶于强酸)具有广泛的应用。
(一)锌的广泛应用
(1)锌被称之为“生命元素”。儿童、青少年如果缺锌严重,将会导致“____ 症”和智力发育不良。经常吃贝壳类海产品、红色肉类等含锌的食物有利补“锌”。这里的“锌”是指__________。
A.单质 B.元素 C.原子 D.分子
(2)实验室用锌与稀硫酸制取氢气,反应的化学方程式为__________________________。
(3)锌与铜熔合可形成“黄铜”,它属于______(选填序号)。
A.金属材料 B.无机非金属材料 C.合成材料 D.复合材料
(二)活性ZnO制取的探究
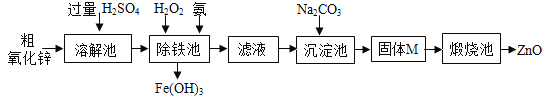
【实验方案】工业上用粗氧化锌(含少量FeO)制取活性氧化锌,其流程如下:
【查阅资料】一些阳离子以氢氧化物形式开始沉淀、完全沉淀时溶液的pH见下表。
沉淀物 | Fe(OH)3 | Zn(OH)2 | Fe(OH)2 |
开始沉淀pH | 1.5 | 6.2 | 6.3 |
完全沉淀pH | 3.2 | 8.0 | 9.7 |
【问题探究】
(4)“溶解”前将粗氧化锌粉碎成细颗粒,目的是___________________。
(5)“溶解”后得到的酸性溶液中含有ZnSO4、____、FeSO4。除铁池中加入适量H2O2,使Fe2+转化为Fe3+;为使溶液中Fe3+全部转化为Fe(OH)3,而Zn2+不形成Zn(OH)2,则应加入氨水控制溶液的pH的范围为_____________。
(6)“沉淀池”中的沉淀经过滤、洗涤等操作得纯净固体M,其组成为:aZnCO3·bZn(OH)2·cH2O。
确认固体M已经洗涤干净的操作是:取最后一次洗涤液,最好选择下列_______,向其中滴入无现象,则已经洗干净。
A.紫色石蕊试液 B.少量稀盐酸 C.氯化钡溶液或硝酸钡溶液
【组成测定】固体B的组成会影响制得的ZnO的活性。为确定aZnCO3·bZn(OH)2·cH2O的组成,进行如下实验(假设每步反应、吸收均完全):
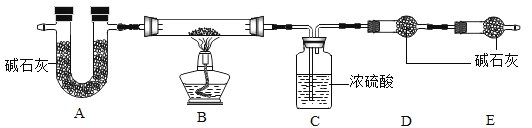
【查阅资料】aZnCO3·bZn(OH)2·cH2O受热分解生成ZnO、H2O、CO2三种产物。
(7)写出装置B中发生反应的化学方程式______________________。
现称取35.9 g aZnCO3·bZn(OH)2·cH2O在B装置中进行完全煅烧,测得装置C和D的质量分别增重7.2 g和4.4 g。
【实验分析及数据处理】
(8)该实验反应前后均需要通入空气,反应后通入空气的目的是_______。
(9)装置A的作用是__________________。
(10)根据上述数据,则生成ZnO的质量为______g;a:b:c=________。
(11)若没有E装置,则测得的a值________(填“偏大”、“ 偏小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com