
科目: 来源: 题型:
【题目】过氧化钙晶体(化学式为:CaO2·yH2O,化学式中的“yH2O”称为结晶水),常温该晶体下为白色,能溶于酸,难溶于水、乙醇,是一种温和的氧化剂,常用于鱼类长途运输的增氧剂等。
(1) 过氧化钙晶体可用下列方法制备:
CaCl2+H2O2+NH3+H2O![]() CaO2·yH2O↓+NH4Cl。
CaO2·yH2O↓+NH4Cl。
用如下制取装置制备过氧化钙晶体。
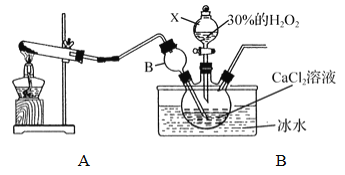
①装置A中生成的气体为________,此装置在初中化学实验中可用于制取_______(填某气体);仪器X的名称为________。
②装置C采用冰水浴控制温度在0℃左右,可能的原因主要有:
Ⅰ. 该反应是放热反应,温度低有利于提高CaO2·yH2O产率;
Ⅱ. ____________________________
③反应结束后,经过滤、洗涤、低温烘干可获得CaO2·yH2O。检验晶体已洗涤干净的方法为:取最后一次洗涤液,滴加____________,若__________,则晶体已经洗涤干净。
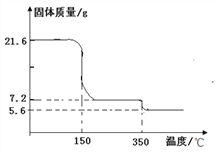
(2)为确定过氧化钙晶体的组成,某化学兴趣小组称取21.6克晶体用热分析仪对其进行热分解实验,并绘制成固体质量与温度关系图(过氧化钙晶体受热时会先失去结晶水),根据下图可知y=_______, 350℃时发生的分解反应方程式为_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学逛超市时发现食品添加剂中有“碳酸氢铵”,感觉很惊讶,“碳酸氢铵”是臭粉啊,怎么可以放进食品?于是开展了以下探究,请你帮助完成下列相关问题。
(1)查阅资料:
①食用级碳酸氢铵比较纯净,可作膨松剂,一般用在油炸食品中,水蒸食品中不用;
②常温常压下,1体积水约能溶解600体积氨气,其水溶液呈弱碱性。
③碱石灰是氧化钙和氢氧化钠的混合物。
(2)产生疑惑:臭粉为何可以作膨松剂?为何一般适用于油炸食品而不适用于水蒸食品?(3)实验设计:实验装置如图,图一是检验装置,图二是收集装置,取适量碳酸氢铵分置于两试管中,按如图进行实验。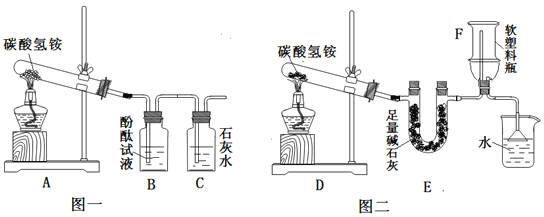
(4)现象与分析:
①图一:B中现象是__________,C中发生反应的化学方程式是_______________。
②图三:装置E的作用是_________,用F装置收集氨气,说明氨气具有_________性质,取下F,塞紧橡皮塞,用注射器向F中注入少量水,震荡,可看到的现象是______,拔出橡皮塞闻到氨味。
(5)解释与结论:①有臭味的碳酸氢铵添加到食品中,如果油炸,则含有的少量碳酸氢铵受热时完全分解,产生的气体使食品膨胀,且生成物可以迅速挥发而离开食品,没有残留物,其臭味会消失,碳酸氢铵受热发生反应的化学方程式是__________
②添加碳酸氢铵的食品如果水蒸,则__________。
通过上述探究该明白了:高纯度的碳酸氢铵可以作为食品添加剂,但同一食品添加剂并不适合所有食品,使用食品添加剂需严格控制用量。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生活密切相关。
Ⅰ.在“①稀硫酸、②水、③熟石灰、④酒精、⑤氯化钾、⑥铁粉”中,请选择适当物质的序号填空:
(1)用于改良酸性土壤的是____________, (2)用于清除铁锈的是_________,
(3)实验室常用的液体燃料是____________, (4)最常见的溶剂____________,
(5)用于防止食物变质的双吸剂____________, (6)可作钾肥的是____________。
Ⅱ.合现有下列五种物质A. 食盐 B. 小苏打 C. 苹果 D. 葡萄糖 E. 维生素A
请按下列要求填空(填序号)。
富含维生素C的是___________;可直接进入血液,补充能量的是________;既可作为疏松剂,又可治疗胃酸过多的是________;食用过多会引起血压升高的________;夜盲症患者可以在医生的指导下补充大量________进行治疗。
Ⅲ.材料是人类生产和生活的物质基础,合理使用材料可以改善我们的生活。
(1)钢铁的生产与使用是人类文明和生活进步的一个重要标志。
①工业上用赤铁矿炼铁的主要化学反应方程式:_______________________________,实验室完成此实验是要注意先____________再___________,目的是为了_____________ 。
②我们还可以采用湿法冶金获得金属,请写出铁与硫酸铜溶液反应的化学方程式: ______________。
③ 炒过菜的铁锅未及时洗净擦干,第二天便会因腐蚀出现红褐色锈斑。铁锅的腐蚀主要是铁与_______和_______反应造成,铁锈的主要成分是________。为防止铁制品锈蚀,可采取的方法有_____________(只需填写一种即可)。
(2) 体育场馆建设需大量建筑材料。下列材料属于复合材料的是________(填字母) ,属于合成材料的是________(填字母)。
a. 石灰石 b. 玻璃钢 c. 玻璃 d 钢筋混凝土 e 聚氯乙烯塑料
Ⅳ.化学的发展为人类解决能源危机带来了曙光。
(1)化学电池是一种高效利用能源的装置,电池在使用时将_______能转化为_______能
(2)下图是某电池的内部结构示意图,
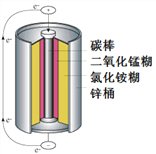
①其中正极为_______,负极为_______。
②请写出用二氧化锰和双氧水混合制取氧气的化学方程式__________________。
③电池材料中的糊状电解质中含有淀粉,我们可以用________(填试剂名称)来检验,检验时课观察到__________________。
④电解液中的氯化铵,再农业生产中可做______肥,施用时要注意__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学用语是学习化学的重要工具
(1)按要求写出相应的化学符号
①碳原子_____②空气中最多的气体_______③锌离子______④两个碳酸根离子______
⑤缺少后会导致骨质疏松的元素_________⑥“西气东输”中的“气”是_______
(2)按要求写出相应的化学方程式,并注明反应的基本类型
①铝在空气中形成致密的保护膜________________________,反应类型____________
②用氢氧化镁治疗胃酸过多_______________________,反应类型____________
③水在通电条件下分解________________________,反应类型____________
④用锌与稀硫酸反应制取氢气________________________,反应类型____________
查看答案和解析>>
科目: 来源: 题型:
【题目】有一包粉末,已知由BaSO4、FeCl3、Ba(NO3)2、Na2SO4、NaOH、NaCl中的几种组成。为了确定其成分,现进行以下实验,各步骤均已充分反应。
步骤一:取一定质量的粉末,加水搅拌后过滤,得到有色沉淀甲和无色溶液A;
步骤二:向步骤一的沉淀甲中加入足量稀盐酸,固体全部消失并得到黄色溶液;
步骤三:将步骤一得到的无色溶液A进行如下图所示的实验。
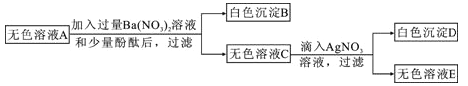
则下列说法中正确的是:
A. 原白色粉末中一定有FeCl3、Na2SO4、NaOH
B. 有色沉淀甲可能是Fe(OH)3和BaSO4 的混合物
C. 若将步骤二中的盐酸换成硝酸,则可确定原白色粉末是否含有NaCl
D. 原白色粉末中FeCl3和NaOH的质量比为65:48
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B两种固体物质的溶解度曲线如图所示,下列说法正确的是
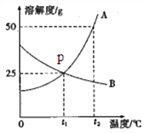
A. A物质的溶解度大于B物质;
B. t1℃时,A、B饱和溶液溶质质量分数都为25%
C. t2℃时A、B的饱和溶液降温至t1℃,所得溶液溶质质量分数相等
D. t2℃时,用等质量的A、B分别配制成饱和溶液,所得溶液质量A<B;
查看答案和解析>>
科目: 来源: 题型:
【题目】铁钉长期放置在潮湿的环境中会生锈(用Fe2O3表示铁锈)。取10g生锈的铁钉放入试管中,用CO还原,充分反应后,称得剩余固体质量为8.8g,请计算:
(1)生成CO2的质量为__________g;
(2)此铁钉中铁锈的质量分数为__________.
查看答案和解析>>
科目: 来源: 题型:
【题目】化学反应速率是衡量化学反应进行快慢的物理量,为了探究影响化学反应速率的因素,以过氧化氢分解为研究对象进行实验。各小组均可采用如图装置进行实验,记录收集10mL氧气的时间,实验室可供选择的试剂有:2.5%、5%、10%三种浓度的H2O2溶液、MnO2、CuO、红砖粉末。

A组:探究催化剂对化学反应速率的影响;
取5mL10%H2O2溶液,三次实验分别加人0.5gMnO2、红砖粉末、CuO进行实验,记录数据如下:
试剂 | MnO2 | 红砖粉末 | CuO |
t/s | 10 | 60 | 20 |
由此得出结论:MnO2、CuO对H2O2分解有催化作用,红砖粉末无催化作用。
(1)你认为该结论是否正确,为什么?_________________________________________。
(2)经过补充对比实验,证明红砖粉末有催化作用,则三者的催化效率由高到低的顺序为___________。
B组:探究浓度对化学反应速率的影响
甲同学:取10mL5%H2O2溶液,加入0.5gMnO2为催化剂,,进行实验,记录时间t1。
(3)乙同学:取10mL2.5%H2O2溶液,加入__________为催化剂,进行实验,记录时间t2。
实验结果:_______________________________________________________
结论:___________________________________________________________
【拓展探究】
(4)C组:探究____________对化学反应速率的影响。
各取10mL5%H2O2溶液和0.5gCuO为催化剂进行实验,两次实验分别将试管置于冰水浴和50℃热水浴,记录时间t3、t4。
(5)实验结果:_________________________;
结论:当反应物浓度和催化剂相同时,__________________________________。
(6)以上三组实验说明,影响化学反应速率的因素有:________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】小明、小芳二位同学为探究盐酸的化学性质,,做了如下实验:
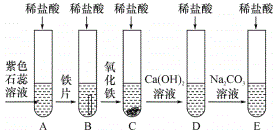
(1)若用pH试纸测该盐酸的pH值,则具体操作为___________。
(2)反应后试管C中一定含有的阳离子是___________(写离子符号);试管D中反应的化学方程式为_________________________________。
(3)小芳同学把反应后D、E试管中的废液倒入一个洁净的烧杯中,观察到先有气泡产生,后有白色沉淀生成,过滤,得到白色沉淀和无色滤液。
小明同学欲探究无色滤液中的溶质成分:
小明同学分析得出无色滤液中一定不含HCl,理由是______________________。
(4)【提出问题】无色滤液的溶质是什么?
【作出猜想】①NaCl;②NaCl和CaCl2;③NaCl和Na2CO3。
【进行实验】
实验步骤 | 实验现象 | 实验结论 |
取少量滤液于试管中,滴加少量①____________ | 无明显现象 | 猜想③成立 |
取少量滤液于试管中,滴加稀盐酸 | ②___________ |
查看答案和解析>>
科目: 来源: 题型:
【题目】随着环境问题的日益严重,垃圾的处理问题正日益被人们所重视。实验室模仿某垃圾处理厂对金属垃圾(主要成分是铁、铜、氧化铁、二氧化硅)处理及综合利用的部分工艺如图所示。
已知:FeSO4容易被空气中的O2氧化。请回答下列问题:
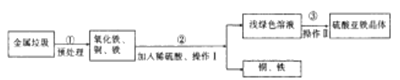
(1)从铜、铁混合物中分离出铁的物理方法为________________________。
(2)操作Ⅰ为____________操作,此操作中玻璃棒的作用是____________________。
(3)步骤②中所发生的反应为Fe+H2SO4==FeSO4+H2↑ 、_____________________、Fe2(SO4)2+Fe==3FeSO4等。
(4)操作Ⅱ是将FeSO4溶液在氮气环境中_________、冷却结品、过滤,得到FeSO4晶体,其中氮气的作用是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com