
科目: 来源: 题型:
【题目】从微观角角度了解物质及其变化,更有利于认识物质组成和变化的本质。
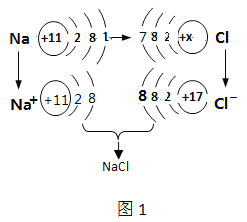
(1)图1是钠原子和氯原子形成氯化钠的示意图
①图中的x=__________。
②从基本反应类型看,钠与氯气的反应属于________反应;从得失电子的角度看,反应中氯原子________(填“得到”或“失去”)1个电子,形成相对稳定结构。
③由图可知,元素的原子失去电子后,其化合价将_____________(填“升高”或“降低”)。
④氯化钠是由___________(填“分子”、“原子”或“离子”)构成的。
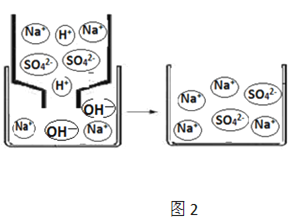
(2)图2描述了NaHSO4与NaOH两溶液反应的微观示意图(图中水分子已略去)。
①NaHSO4的名称是________________。
②该反应的本质是___________________结合生成水
③写出与上述反应本质相同的另一化学方程式:_________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】水是一种重要的物质,在日常生活和和生产实践中有着不可替代的作用。
|
|
|
|
图1 | 图2 | 图3 | 图4 |
(1)水的净化
①图1所示净水器可除去水中的色素和异味,是因为其中的活性炭具有_____________性。
②在图1和图2示意的净水原理中,能降低水硬度的净水方法是图______(填“1”或2)。
(2)水的组成。
①图3是水的电解装置,接通直流电源一段时间后,玻璃管b内产生的气体是__________________,该反应的化学方程式为_____________________________。
②电解水的实验中,在玻璃璃管里加含有酚酞的硫酸钠溶液,可以增强导电性。在实验过程中,观察到管a电极附近的溶液迅速变红,则该处溶液呈_______(填“酸”“碱”或“中”)性。电解后,待溶液混合均匀后测得溶液的pH=7,则图4中能表示电解时管b中水在电极端所发生变化得到的粒子是_____(填对应选项的字母)。
(3)水在化学实验中具有重要作用。
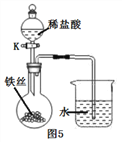
将铁丝放在潮湿的空气中(如图5所示),关闭K,一段时间后,观察到导管内液面上升;打开K,观察到导管内液面下降,导管口有气泡出。请解释导管内液面上升和下降的原因:_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某地规定:工业排放的气中SO2的含量不超过0.4mgL-1,某兴趣小组利用反应SO2+l2+2H2O=H2SO4+2HI,测定某工业废气中SO2的含量,测试装置如图所示。
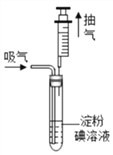
测试步骤:
①碘溶液的配制:准确称取1.27g碘单质,加入少量碘化钾,先溶解在100mL水中,续加水配制成1000mL溶液。
②取5mL上述溶液,加入试管中,滴入2~3滴淀粉试液,溶液变蓝。
③把100mL注射器的活塞推到底后,插入试管的橡皮塞中,如图所示。然后缓缓向外拉注射器,每次抽取的气体为100mL,重复抽取n次,直到溶液变为无色(废气中的其它成分不与淀粉碘溶液反应)。
(1)步骤②中,5mL溶液中溶有碘单质_______mg,步骤③中缓缓向外拉注射器,“缓缓”的目的是_______,
(2)按步骤测试某工业废气,抽取次数为80次后,溶液刚好变为无色,试计算该废气中SO2含量,并判断是否符合排放标准。__________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】我国劳动人民早在五千年前就会使用木炭炼铜。某化学兴趣小组在实验宝里模拟炼铜,开展如下图所示的探究活动。
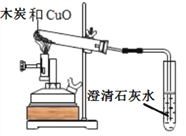
Ⅰ.验证单质碳的还原性
(1)加热固体,2min后,观察到固体变红或澄清石灰水__________,证明碳具有还原性。
(2)CuO发生________反应(填“氧化”或还原”)
(3)反应结束时,停止实验的第一步操作是__________________。
Ⅱ,探究反应后红色固体的成分
【查阅资料】(1)木炭与CuO的反应是:C+2CuO高温2Cu+CO2↑,若该反应进行的不彻底,产物中可能还含有氧化亚铜(Cu2O)。
(2)Cu2O是红色固体,能与稀硫酸反应Cu2O +H2SO4=Cu+ Cu SO4+H2O
【作出猜想】红色体的成分: a全部是Cu ;b.全部是Cu2O ;c.全部是___________
【实验步骤】取试管内红色同体,进行如下实验验证:
①取1.44g红色固体装入试管,滴入足量稀硫酸,观察到红色体部分减少,溶液变为____色,则猜想a错误。
②过滤,滤出试管中残留的红色固体,干燥,称其质为1.04g,则猜想______正确。理由是____________。
【评价反思】在的铜冶炼史中,我国劳动人民还有一项重大发明就是“湿法炼铜”,该方可用化学方程式表示为_____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某科研小组设计利用稀H2SO4浸取某废弃的氧化铜锌矿(主要成分为CuO和ZnO,其余成分既不与酸反应,也不溶解于水)的方案。部分实验流程如下:
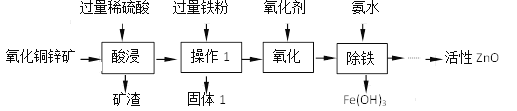
已知:①H2O2、KMnO4是常见的氧化剂
②各离子开始沉淀及完全沉淀时的pH如下表所示。
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe3+ | 1.48 | 3.2 |
Zn2+ | 6.2 | 8.0 |
请根据上述实验流程回答下列问题:
(1)在“酸浸”步骤中,为提高浸出速率,除通入空气“搅拌”外,还可采取的措施是_________,写出硫酸溶解氧化锌的化学方程式为_________________。
(2)“操作1”所需要的主要玻璃仪器有______________________,固体1的成分是___________。
(3)“氧化”的目的是将Fe2+反应生成Fe3+,以便在后续的操作中将溶液中铁元素除去从产品纯度的角度分析,氧化剂最好选用_________________(填“H2O2"或“KMnO4”)。
(4)“除铁”过程中加入氨水的目的是通过调节溶液的pH,使Fe3+沉淀而Zn2+不沉淀,pH应控制在_______范围之间。
(5)某温度下,Fe(OH)3分解得到一种铁、氧质量比为21:8的氧化物,该氧化物的化式__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将一定量的丙醇(CH308)和氧气置于一个封闭的容器中引燃,其反应的化学方程式为: a C3 H8O+ b O2点燃 cCO2+dH2O+eX,测得反应前后各物质的质量如下表:
物 质 | 丙醇 | 氧气 | 水 | 二氧化碳 | X |
反应前质量/g | 6.0 | 12.8 | 0 | 0 | 0 |
反应后质量/g | 0 | 0 | 7.2 | 8.8 | x |
下列判断正确的是
A. 表中x的值为2.8
B. X可能是该反应的催化剂
C. X可能为甲烷
D. 方程式中a:b=1:3
查看答案和解析>>
科目: 来源: 题型:
【题目】通过下列实验,不能达到实验目的的是

A. 通过观察甲装置小试管中产生气泡的速率,比较MnO2和CuO的催化效果
B. 通过观察乙装置烧杯中红磷未燃烧,说明红磷的着火点高于40℃
C. 通过观察丙装置气球的大小变化,比较NaOH和NH4NO3固体溶解的热效应
D. 通过观察丁装置沾有澄清石灰水的烧杯壁是否出现浑油,鉴别气体CO和CH4
查看答案和解析>>
科目: 来源: 题型:
【题目】为解决水中氧气不足的问题,通常向鱼池中撒一种微黄色的固体,这种固体的主要成分是过氧化钙(CaO2),CaO2与Na2O2都属于过氧化物,它们的化学性质非常相似。过氧化钠与水反应的化学方程式是:2Na2O2+2H2O=4NaOH+O2↑
⑴写出CaO2与H2O反应的化学方程式______________________________________;
⑵现称取20g样品加入到足量的水中,结果生成3.2g O2(样品中其它成分与水不反应)。请计算该样品中CaO2的质量分数___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】草酸的化学式为H2C2O4,甲、乙两同学对草酸受热分解产物的检验做了探究:
(1)猜想与假设:第一种:草酸分解产物是CO2和H2;第二种:草酸分解产物是CO2、CO和H2O;第三种:草酸分解产物是CO2和H2O。
(2)实验装置的设计(图中铁架台略去)甲同学设计了如图1所示的装置。乙同学设计了如图2所示的装置。
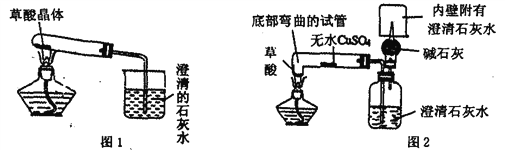
(3)实验:甲同学按图1装置实验,观察到澄清石灰水变浑浊。乙同学按图2装置实验,观察到无水硫酸铜由白色变成蓝色,澄清的石灰水变浑浊,且生成的气体通过碱石灰后,在尖嘴处点燃后能燃烧,在火焰上方罩一个内壁附有澄清石灰水的烧杯,澄清的石灰水变浑浊。
(4)结论:第___种猜想是正确的,请写出草酸受热分解的化学反应方程式__。
(5)反思与评价:
乙同学认为甲同学设计的实验装置有缺陷。由于试管口向下倾斜,而且草酸晶体熔点较低,加热到182℃便开始熔化,因此实验中常会出现熔融的草酸流进导管而影响后续实验。甲同学认为乙同学的设计是科学合理的。请你谈谈图2装置优于图1装置之处:
第一点:__________。第二点:_______________。
第三点:_______________。
乙同学设计的图2装置也能证明产物中无H2,证明方法是______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】为了维护南海权益,我国在2012年宣布成立了三沙市。这是维护国家主权的象征,同时也是因为海洋资源十分丰富,有广泛的利用价值。其中通过海水晾晒即可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是制备精盐的实验方案,各步操作流程如下:

(1)根据以上信息,请写出海水中所含的主要阴离子的符号___________。
(2)在上述流程中第③步加过量NaOH的目的是除去海水中的________(填离子符号,下同),第④步加过量Na2CO3的目的是除去海水中和所加入试剂中的_____。第⑥步其实显示的是加适量盐酸,其目的是除去多余的___________ 。
(3)在第④步操作中,选择的除杂试剂不能用K2CO3代替Na2CO3,理由是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com