
科目: 来源: 题型:
【题目】某恒温容器中盛有NaOH饱和水溶液且仍有部分NaOH固体剩余,向容器中缓慢滴加稀硫酸,经测定,溶液pH随加入稀硫酸质量的变化如图1所示,(已知溶液中![]() 浓度越大,溶液碱性越强;
浓度越大,溶液碱性越强;![]() 浓度越大,溶液酸性越强)
浓度越大,溶液酸性越强)
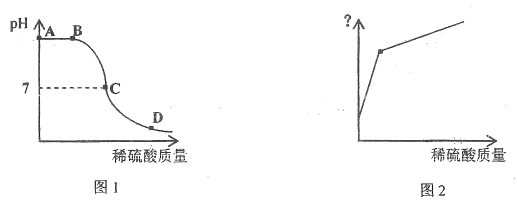
(1)写出实验过程中发生反应的化学方程式_____________
(2)从A点到B点过程中,溶液所含溶液NaOH的质量____(填“不变”或“变大”或“变小”)。
(3)写出D点对应溶液的溶质__________(填化学式)。
(4)图2中纵坐标可表示________(填序号)。
①溶剂质量 ②溶液质量 ③NaOH溶质质量分数
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下表回答问题:
温度/℃ | 20 | 40 | 60 | |
溶解度 | NaCl | 36.0 | 36.6 | 37.3 |
| 31.6 | 63.9 | 110 | |
(1)60℃,100g水中最多能溶解![]() 的质量为__________。
的质量为__________。
(2)下列说法正确的是_________(填序号)。
A.20℃时,![]() 饱和溶液的质量分数为31.6%
饱和溶液的质量分数为31.6%
B.40℃时,136.6gNaCl溶液中一定含有36.6gNaCl
C.将40℃时![]() 的饱和溶液降温到20℃,析出32.3g
的饱和溶液降温到20℃,析出32.3g![]() 固体
固体
D.将40℃时NaCl和![]() 的饱和溶液分别降温至20℃,降温后两溶液质量分数的大小关系为NaCl>
的饱和溶液分别降温至20℃,降温后两溶液质量分数的大小关系为NaCl>![]()
(3)20℃时,按下列图示操作:
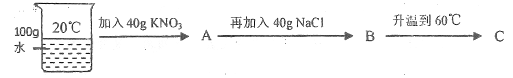
①在溶液A、B、C中,![]() 溶解达到饱和状态的有_______(填字母)。
溶解达到饱和状态的有_______(填字母)。
②比较溶液A、B中![]() 的质量分数:A_______B(填“>“或” <”或“=”)。
的质量分数:A_______B(填“>“或” <”或“=”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】正常雨水因溶解了少量二氧化碳,pH为5.6,化石燃料燃烧可能产生![]() ,最终导致降雨的酸性增强,下图是形成酸雨的其中一条途径:
,最终导致降雨的酸性增强,下图是形成酸雨的其中一条途径:

(1)我们把pH_____5.6(填“>”“<”或“=”)的降雨称为酸雨。
(2)以上途径的各物质中,硫元素的化合价有_______种。
(3)为减少酸雨危害,下列措施合理的有_________(填序号)
①减少汽车尾气排放 ②禁止使用化石燃料
③将燃煤锅炉烟囱加高 ④开发风能、太阳能等新能源
(4)可用氢氧化钠溶液吸收二氧化硫,其化学方程式为______________________。
(5)![]() 通入碘水(
通入碘水(![]() 的水溶液)会生成硫酸和氢碘酸(HI),我们可利用此原理来测定空气中
的水溶液)会生成硫酸和氢碘酸(HI),我们可利用此原理来测定空气中![]() 的含量,该原理的化学方程式为___________________。
的含量,该原理的化学方程式为___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】以下推理正确的是( )
A. 浓硫酸具有脱水性,则浓硫酸可以做干燥剂
B. ![]() 溶液可以使酚酞变红,则可以使酚酞变红的一定是碱溶液
溶液可以使酚酞变红,则可以使酚酞变红的一定是碱溶液
C. 某物质饱和溶液降温析出晶体,则析出晶体后的溶液一定是该物质的饱和溶液
D. 向某物质加入氯化钡和过量硝酸,出现白色沉淀,则原溶液中一定含有![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】请从A、B两题中任选一个作答。若两题均答,按A计分。
题号 | A | B |
实验目的 | 探究_________ | 探究________ |
实验装置 |
|
|
实验原理 | (1)化学方程式是_______ | (1)化学方程式是_______ |
部分实验现象 | (2)溶液蓝色逐渐变浅,天平指针_______; | (2)如图,缓慢打开左端活塞,a处可观察到_______; |
查看答案和解析>>
科目: 来源: 题型:
【题目】硝酸(HNO3)是实验室常见的一种酸。实验小组对硝酸的某些性质进行研究。
Ⅰ.挥发性
(实验1)取一瓶质量分数为68%的浓硝酸,打开瓶盖,遇潮湿的空气,瓶口可以看到________,是由于挥发出来的硝酸蒸体遇到空气里的水蒸气形成硝酸小液滴的缘故。
Ⅱ.不稳定性
(查阅资料1)硝酸是无色液体,见光或受热分解生成红棕色的NO2气体。
(1)硝酸分解的化学方程式为:4HNO3 ![]() 4NO↑+O↑+_____。
4NO↑+O↑+_____。
(实验2)取3份浓度和体积均相同的浓硝酸分别放入3支试管中,塞好塞子,放置在室外阳光充足的地方(气温为26℃)。记录溶液上方的气体颜色随时间的变化情况。
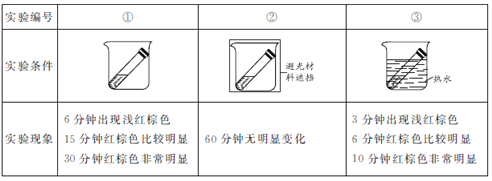
(2)实验①、②对比是研究______对浓硝酸稳定性的影响。
(3)实验①、③对比可得出的结论是_______。
Ⅲ.酸性
(查阅资料2)硝酸能够与金属氧化物反应生成盐和水。
(实验3)向氧化铜粉末中加入硝酸,能够看到的现象是_______。
IV .氧化性
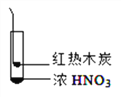
(查阅资料3) 浓硝酸在加热条件下能与木炭发生反应:C+4HNO(浓) ![]() 4NO↑+CO↑+2H2O。
4NO↑+CO↑+2H2O。
(实验4)如图所示,将红热的木炭伸到浓硝酸上方,观察到有红棕色气体产生。请解释生成该红棕色气体的原因可能有________。
查看答案和解析>>
科目: 来源: 题型:
【题目】最近科学家提出了一种“绿色自由”构想,先把空气吹入碳酸钾溶液中,再把二氧化碳从溶液中提取出来,在合成塔中转化为甲醇(CH3OH)。具体流程如下:
(已知:CO2+K2CO3 +H2O = 2KHCO3)
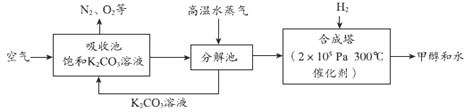
(1)吸收池的作用是_______。
(2)碳酸氢钾(KHCO3)在分解池中发生分解反应,其反应条件是_______。
(3)合成塔中反应的化学方程式是______。
(4)如果空气不经过吸收池和分解池,直接通入合成塔,从安全的角度考虑不可行,理由是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】小明通过实验证明二氧化碳能与氢氧化钠反应,并检验生成了碳酸盐。
25℃时,氢氧化钠和碳酸钠在乙醇中的溶解度如下表所示。
物质 | NaOH | Na2CO3 |
溶解度/g | 17.3 | <0.01 |
利用如图所示装置进行实验(该装置气密性良好;乙醇不参与反应)。

[步骤1]打开K1,关闭K2,从a口通入二氧化碳,看到饱和氢氧化钠的乙醇溶液中产生大量沉淀,停止通二氧化碳;
[步骤2]从a口通入氮气,直至排净装置中的二氧化碳;
[步骤3]关闭K1,打开K2,向甲装置的试管中滴入足量的稀盐酸。
(1)步骤1装置甲的试管中能看到沉淀的原因是______。
(2)步骤2中,排净装置甲中二氧化碳的目的是______。
(3)步骤3乙中能看到的现象是________,反应的化学方程式是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】阅读下面科普短文。
SO2是一种无色、有刺激性气味、易溶于水的气体。SO2是大气主要污染物之一,是形成酸雨的主要物质。据统计, 我国大气中93.9%的SO2 来自煤炭燃烧。1998年我国正式确定了控制SO2污染的政策和措施,对SO2排放总量进行控制。
控制SO2污染的方法有:燃料在燃烧前脱硫、燃烧中脱硫及燃烧后脱硫( 即烟气脱硫)。烟气脱硫技术, 是当前应用最广、效率最高的实用脱硫技术。
烟气脱硫方法一般可分为干法和湿法两大类。湿法烟气脱硫是指应用液体吸收剂(如水或碱性溶液)洗涤含SO2的烟气,脱除烟气中的SO2。干法烟气脱硫, 是指应用干粉状或颗粒状吸收剂等来处理含SO2的烟气, 使烟气中的SO2被吸收。
实验室可以用图1装置模拟干法烟气脱硫。将煤粉碎,使其颗粒大小均匀,取3份0.5 g煤粉,其中2份分别添加0.1g 碳酸钙、0.1g碱石灰(CaO和NaOH)作为吸收剂,混合均匀后,在坩埚中进行煤燃烧实验。用SO2传感器测出3份煤燃烧过程中所排放的烟气中SO2的含量(见图2)。
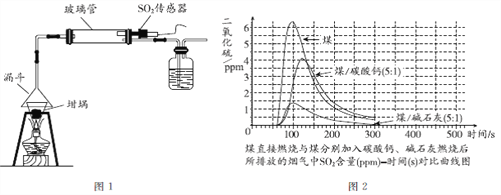
湿法烟气脱硫的优点是脱硫效率高, 稳定;缺点是能耗高,易造成二次污染, 并存在废水处理等问题。干法烟气脱硫的优点是能耗低,工艺过程简单, 无污水、无酸处理问题等。
依据文章内容,回答下列问题:
(1)大气中的SO2主要来自___________。
(2)SO2的物理性质有______(答出一条即可)。
(3)干法烟气脱硫所使用的吸收剂碱石灰属于_________(填“纯净物”或“混合物”)。
(4)实验室模拟干法烟气脱硫时,采用科学的实验研究方法是______(写出一种方法即可)。
(5)下列说法不正确的是_____(填字母序号)。
A.控制SO2的污染只能通过烟气脱硫技术解决
B.干法烟气脱硫技术与湿法烟气脱硫技术各有利弊
C.煤中加入不同吸收剂,对烟气中SO2的吸收效果不同
查看答案和解析>>
科目: 来源: 题型:
【题目】中科院研制出一种将二氧化碳成功转化为汽油的方法,其流程如下图所示。(下图中a、b是两种起始反应物的分子模型,c、d是最终制得的汽油中所含两种物质的分子模型)
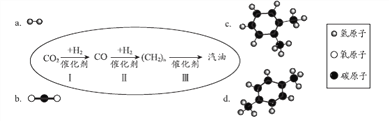
(1)物质d中碳元素与氢元素的质量比为_____。
(2)请从原料或产品的角度,分析该成果能够解决的现实问题是______(答出一点即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com