
科目: 来源: 题型:
【题目】水是生命之源,是人类最宝贵的资源。、
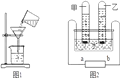
(1)自然界中的水都不是纯水。水中的色素、异味可用________吸附,天然水有硬水和软水之分,生活中可用_______来区分,常用_____的方法降低水的硬度。
(2)某同学将浑浊的湖水样品倒入烧杯中,先加入白色粉末搅拌溶解,静置一会后,用上图1所示的装置进行过滤,可除去水中__杂质,图1中还缺少的一种仪器,该仪器的作用是_______。改进后过滤,得到了澄清透明的水,这种水是___填纯净物、混合物),他按上图2将该水电解:__(填甲或乙)试管里产生的是氧气,甲乙产生气体质量比为_____。
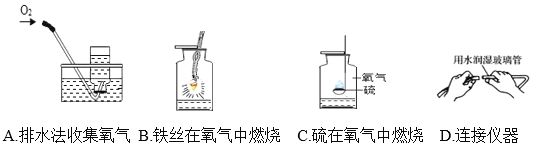
(3)实验室在进行下图所示的实验中都要用到水,关于水的主要作用说法不正确的是______。
A.集气瓶中的水:水先将集气瓶内的空气排净,后便于观察氧气何时收集满
B.集气瓶中的水:冷却溅落融熔物,防止集气瓶炸裂
C.集气瓶中的水:吸收放出的热量
D.连接仪器时起润滑作用
(4)写出B中反应的化学方程式:__________________。
(5)写出C中反应的化学方程式:_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】元素周期表是学习和研究化学的重要工具。请根据下表(元素周期表的部分内容)回答有关问题:
| I A | II A | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | 3 Li 锂 6.941 | 4 Be 铍 9.012 | 5 B 硼 10.81 | 6 C 碳 12.01 | 7 N 氮 14.01 | 8 O 氧 16.00 | 9 F 氟 19.00 | 10 Ne 氖 20.18 |
3 | 11 Na 钠 22.99 | 12 Mg 镁 24.31 | 13 Al 铝 26.98 | 14 Si 硅 28.09 | 15 P 磷 30.97 | 16 S 硫 32.06 | 17 Cl 氯 35.45 | 18 Ar 氩 39.95 |
(1)画出16号元素的原子结构示意图_______,其阴离子符号是_____,其相对原子质量___。
(2)表中3至10号元素位于第二周期,11至18号元素位于第三周期,从原子结构示意图分析其规律可知,每一周期元素原子的_____________ 相同。
(3)表中9号和17号元素最外层电子数相同,都易________(填“得到”或“失去”)电子,则钠元素和氟元素组成的化合物的化学式为________。第11号元素与第17号元素能组成化合物,构成该物质的微粒是____(选填“分子”、“原子”或“离子”)。
(4)在元素周期表中,同一族(纵行)的元素具有相似的化学性质。则下列各组元素具有相似化学性质的是__________(填标号)。
a. C和Ne b. Be和Mg c. Al和Si d. F和Cl
查看答案和解析>>
科目: 来源: 题型:
【题目】在一次探究活动中,小强用玻璃管向新制的澄清石灰水中不断吹气,在吹气的过程中发现石灰水先出现浑浊后又变澄清,他感到很意外。小强又将纯净的CO2持续通入新制的澄清石灰水中,一段时间后,观察到的现象与上次相同。
(1)小强做第二次实验的目的是___________。
(2)小强从老师那里得知:CO2能与CaCO3和H2O继续反应生成碳酸氢钙[Ca(HCO3)2]。由此小强推测出Ca(HCO3)2的一条物理性质是___________。
(3)小强还想了解Ca(HCO3)2的化学性质。查阅资料后得知碳酸氢钙[Ca(HCO3)2]受热易分解,生成难溶性的化合物、气体等物质。他与同学们一起对碳酸氢钙受热分解后产物的成分进行了探究。
(提出猜想)
猜想1.生成的难溶性化合物可能是碳酸钙。经实验探究结论正确。
猜想2.放出的气体可能是O2、H2、CO、CO2 、N2中的一种或几种。
(查阅资料)所有化学反应前后元素的种类都不变。由此,同学们排除了气体为N2
的可能性。
(实验探究)小强同学设计如下实验,探究气体的成分。
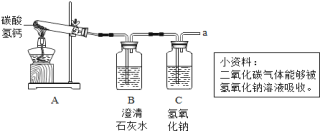
操作1.加热A装置,一段时间后,B装置中的澄清石灰水变浑浊。
操作2.在a处用燃着的木条检验,无明显现象。
(实验结论)结论1.碳酸氢钙分解产生的气体一定有__________。
结论2.碳酸氢钙受热分解的文字表达式:碳酸氢钙 ![]() 碳酸钙+二氧化碳
碳酸钙+二氧化碳
(表达交流)
交流1.从安全的角度考虑,操作2实验中存在的不足是____________。
交流2.小组内某同学对上述结论提出异议:
该同学的观点 | 是否同意该同学的观点并阐述理由 |
该实验没有对氧气进行验证 | __________ |
“结论2”不正确 | __________ |
查看答案和解析>>
科目: 来源: 题型:
【题目】用适当的化学用语填空:
(1)2个氧分子:_____(2)3个镁离子:______(3)标出氧化钙中钙元素显+2价:____
(4)5个硫酸根离子________(5)碳酸钠中的阴离子的符号_________
(6)地壳中含量最多的元素与地壳中含量最多的金属元素形成的化合物是____
查看答案和解析>>
科目: 来源: 题型:
【题目】化学是一门以实验为基础的科学,化学所取得的丰硕成果,与实验的重要作用分不开。请根据下图回答问题:
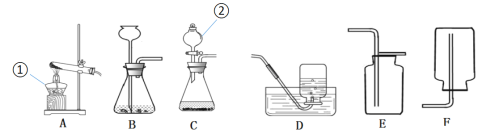
(1)写出图中数字②所代表的仪器名称:__________,
(2)若要在实验室用高锰酸钾制取并收集一瓶氧气,你应选择图中的_______(填字母序号)作为发生装置,其相应的文字表达式:________,如果要想收集到一瓶较干燥的氧气来做蜡烛在氧气中燃烧的实验,收集装置应选_____(填字母序号)。验证氧气的方法是__________。
(3)在化学分组实验课上,老师要求用过氧化氢溶液和二氧化锰来制取氧气,在选择发生装置时,小桐和小晨发生了争论。最后经讨论,他们选择了C装置,你认为他们选择C装置的理由是__________,该反应的化学式表达式为_____________。
(4)小桐选B装置用稀盐酸和石灰石制取二氧化碳,收集装置应选择______(填字母序号),检验二氧化碳是否收集满的方法是_____________。
(5)乙炔是一种无色、无味、密度比空气略小,不溶于水的气体。工业上常用它燃烧产生的高温来切割和焊接金属,实验室用电石(固体)与水在常温下反应(反应很剧烈)制取乙炔。你认为制取乙炔应选择的发生装置是_______(填字母序号),小明想收集到较纯净的乙炔气体,他应该选的收集装置是_______。
(6)下图所示装置是一个多用途的装置(又称万能瓶),当用于收集气体时既可以为排水法、又可以为向下排空气法和向上排空气法。现在小娟同学想用排空气法收集一瓶乙炔气体,在该装置不改变放置方式的情况下,她应将乙炔从______(选填“a”或“b”)端通入。

查看答案和解析>>
科目: 来源: 题型:
【题目】为了检测石灰石样品中碳酸钙的含量,甲、乙、丙、丁四位同学分别用质量分数相同的盐酸与样品充分反应进行实验测定。已知,样品中的杂质不溶于水,且不与盐酸反应。测得数据如下表:
甲 | 乙 | 丙 | 丁 | |
所取石灰石样品质量/g | 10.0 | 10.0 | 10.0 | 10.0 |
加入盐酸的质量/g | 20.0 | 30.0 | 45.0 | 50.0 |
剩余固体的质量/g | 6.0 | 4.0 | 2.0 | 2.0 |
请回答:
⑴ 样品中碳酸钙的质量分数是_______;
⑵10.0 g样品与45.0 g盐酸充分反应后,盐酸是否还有剩余_______(填“是”或“否”);
⑶10.0 g样品与足量稀盐酸反应后可产生二氧化碳_____克?(写出计算过程,计算结果精确到0.1 g)
(可能用到的相对原子质量:H—1 C—12 O—16 Cl—35.5 Ca—40)
查看答案和解析>>
科目: 来源: 题型:
【题目】今年国庆节长假期间,小刚同学到长江三峡旅游,带回来一瓶山峡的江水,他在实验室模拟自来水厂的净水过程,最终制成自来水。其实验流程如下图所示。请回答以下问题。
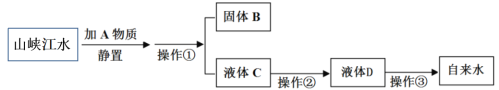
(1)操作①的名称是_________;现实验室提供了烧杯、漏斗、铁架台、滤纸和玻璃棒等用品,在该操作中,玻璃棒的作用是__________。
(2)对于饮用水而言,长期饮用硬水对人体健康不利,区分硬水和软水最简单的方法是加_____________。
(3)操作②主要是除去一些异味和色素,在实验中他应选用的物质是_____________,该过程主要是___________(填“物理”或“化学”)变化。
(4)小刚发现经过净化后的液体D是硬水,日常生活中常常用__________的方法使其软化后使用。操作③是消毒杀菌,这个过程主要是_________(填“物理”或“化学”)变化。
查看答案和解析>>
科目: 来源: 题型:
【题目】写出下列反应的文字表达式:
(1)碳酸氢铵受热分解_____________。
(2)电解水生成氢气和氧气____________。
(3)加热氯酸钾和二氧化锰的混合物制取氧气__________。
(4)氧化钙和水反应生成氢氧化钙______________。
(5)露置在空气中的澄清石灰水表面形成一层白膜_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】请用所学过的化学知识填空:
(1)人体中含量最多的物质_______(填化学式);
(2)电解水(H2O)生成了氢气(H2)和氧气(O2),说明水是由______________组成的;
(3)实验室常用澄清石灰水检验二氧化碳,其原理是澄清石灰水中的氢氧化钙和二氧化碳反应生成不溶于水的白色固体碳酸钙。氢氧化钙的化学式是Ca(OH)2,其相对分子质量为_______;
(4)1个氟原子的质量为3.156×10-26Kg,一个碳(碳-12)原子的质量为1.993×10-26Kg,则氟的相对原子质量为______(计算结果保留整数);
(5)若相对原子质量为M的原子,核外有N个电子,其核内中子数为是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】云通过探究发现,氯酸钾与氧化铜(CuO)、氧化铁(Fe2O3)混合加热,也能较快产生氧气,于是进行如下探究:
(查阅资料)氯酸钾的熔点为356℃,常温下稳定,在400℃以上则分解产生氧气。酒精灯加热温度为400℃~500℃。
(提出猜想)除MnO2、CuO外,Fe2O3也可以作氯酸钾分解的催化剂。
(完成实验)按下表进行实验并测定分解温度。
实验编号 | 实验药品 | 分解温度 |
1 | 3.0g氯酸钾 | 460℃ |
2 | 3.0g氯酸钾和0.5g二氧化锰 | 248℃ |
3 | 3.0g氯酸钾和0.5g氧化铜 | 267℃ |
4 | 3.0g氯酸钾和Xg氧化铁 | 290℃ |
(分析数据,得出结论)
(1)实验3的化学反应式:______________________。
(2)小云从下图中选择该实验的最佳发生装置是__________。
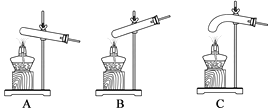
(3)实验4中X的值应为__________,由实验__________与实验4对比,证明猜想合理。
(4)通过实验测得的数据,小云绘出了部分下图,请帮他完成该图。
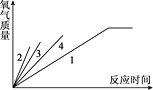
(结论)通过该实验探究中,得到的结论有__________(填序号)。
A.催化剂可降低反应温度
B.二氧化锰只能催化氯酸钾的分解
C.催化剂的质量和性质在反应前后不变
D.催化剂可改变产物的质量
E.三种催化剂中,二氧化锰对氯酸钾分解催化效果最好
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com