
科目: 来源: 题型:
【题目】现有下列实验装置图,结合该图回答下列问题。
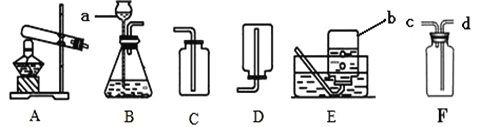
(1)写出图中标号仪器的名称:a_______。
(2)用高锰酸钾为原料制取较纯净的氧气可选用的装置组合为_________(填字母,下同),发生装置应作的改进是___________,发生的化学方程式为___________,该反应的基本类型是_____反应。
(3)实验室选用B装置来制取二氧化碳,发生反应的化学方程式为______,若用F装置来收集二氧化碳,证明已经收集满CO2的方法是_________ 。
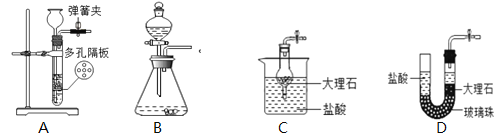
(4)该小组在制取CO2的时侯,发现二氧化碳收集好后,反应仍在发生,所以,他们想设计一个能随时控制反应的发生与停止的装置,你觉得下图装置中能实现上述意图的是_______。
(5)小鹏同学设计的实验装置(如图), 既可用于制取气体, 又可用于验证物质性质。

①当打开K1、关闭K2时,利用I、Ⅱ装置可直接进行的实验是_____(填序号)。
A.大理石与稀盐酸反应制取二氧化碳
B.锌(固体)与稀硫酸反应制取氢气
②小晨同学打开K2、关闭K1,利用I、Ⅲ装置来验证生成的二氧化碳,此时烧杯中盛放的试剂是______(填名称),若要证明二氧化碳能与水发生反应,此时烧杯中盛放的试剂是______(填名称)。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学就在我们身边,请用所学的化学知识填空。
(1)现有H、C、O三种元素常见的元素,选择适当的元素组成符合下列要求的物质各一种(用化学式表示):
①具有还原性的气体化合物 ________;②天然气的主要成分_______;
③可作制冷剂的干冰________;④可用于炼钢的气体________。
(2)化学课上老师表演了一个小魔术——“无中生有”:相同条件下,向A、B两个体积相同的集气瓶中分别充满无色的硫化氢(H2S)气体和二氧化硫气体。如图所示,抽开毛玻璃片,瓶口对紧,颠倒几次,使两种气体充分混合。一会儿,观察到两瓶内壁附着淡黄色固体颗粒。请回答下列问题:
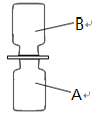
①若用“![]() ”表示氢原子,用“
”表示氢原子,用“![]() ”表示氧原子,用“
”表示氧原子,用“![]() ”表示硫原子,上述反应过程可用下图表示:
”表示硫原子,上述反应过程可用下图表示:

该反应的化学方程式为________;请标出硫化氢中硫元素的化合价_______。
②已知:相同条件下,相等体积的气体所含的分子数目相等。反应完毕,瓶中剩余的气体为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】氨气是一种密度比空气小、有刺激性气味的气体。加热条件下,氨气能将氧化铜还原成铜,反应的化学方程式为: 3CuO+2NH3![]() 3Cu+3H2O+N2,如下图所示,挤压鼓气球把空气鼓入盛有浓氨水的集气瓶中,使氨气进入试管,用酒精灯给试管加热,即可达到实验目的。关于该实验,有下列几种说法:
3Cu+3H2O+N2,如下图所示,挤压鼓气球把空气鼓入盛有浓氨水的集气瓶中,使氨气进入试管,用酒精灯给试管加热,即可达到实验目的。关于该实验,有下列几种说法:
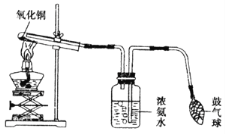
① 实验中,试管口应略向下倾斜;
② 反应一段时间后,可看到试管内有红色物质生成;
③ 反应结束时,先撤出导气管,再熄灭酒精灯,以免液体倒流;
④ 该装置没有对尾气进行处理,会污染空气。
以上说法正确的是( )
A. ①②④ B. ②③④ C. ①②③④ D. 只有①②
查看答案和解析>>
科目: 来源: 题型:
【题目】美国普度大学研发出一种制备氢气的新工艺,流程如下图所示.下列说法错误的是( )
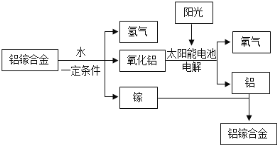
A. 铝镓合金可以循环使用
B. 流程中的氧化铝、水和氧气都属于氧化物
C. 太阳能的利用可以部分解决能源危机问题
D. 铝镓合金与水反应的化学方程式为:2Al+3H2O ![]() Al2O3+3H2↑
Al2O3+3H2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学考察了一家化工厂的污水处理情况,结果测得污水水样的pH=3.取一定量的污水用2%的氢氧化钠溶液中和至pH=7(已知污水中其他成分不与氢氧化钠反应),消耗氢氧化钠溶液质量为40g,反应后的溶液质量为113g。
(1)污水水样显_____性(填“酸”、“碱”或“中”)。
(2)若污水中的污染物是盐酸,求污水中HCl的质量分数_______。
(3)若污水中的污染物是硫酸,求至pH=7时,所得溶液溶质的质量分数______。
查看答案和解析>>
科目: 来源: 题型:
【题目】小明同学配制100g 10%的氯化钠溶液,整个操作过程如图所示:回答下列问题:
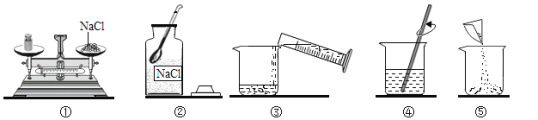
(1)图②中盛放氯化钠的固体的仪器名称是_____。其中操作错误的是________(填序号)
(2)配制溶液的正确操作顺序为_____________ (填序号)
(3)量水时选用的量筒的量程最合适的是_______。(填序号)
A.10ml B.25ml C.50m D.100ml
(4)经检测,该同学配制的溶液溶质质量分数偏小,可能的原因是________ (填序号)
A. 氯化钠固体不纯 B.用生锈的砝码称量
C.装瓶时有少量溶液洒出 D.溶解时烧杯内壁有水珠
(5)请你帮小明完成以下计算:
①要配制100g 10%的氯化钠的溶液,需要称取食盐______ g.加入水_______ g。
②若要将100g 10%的氯化钠溶液稀释成2%.需要加入水的质量______g。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A、B、C、D、E是初中化学中常见的不同类别的物质,它们之间的关系如图所示(“→”表示物质间的转化关系,“﹣”表示两端的物质能发生化学反应).A是使用最广泛的金属,C是常用的食品干燥剂,E是配制波尔多液的主要成份之一,其溶液为蓝色,F是由三种元素组成的化合物,广泛用于肥皂,石油,印染和纺织等方面,请回答下列问题

(1)写出化学式: A______.
(2)物质F所属的物质类别是_______,写出其和B反应的方程式__________
(3)依次写出C→ D, B→ E的化学方程式___________.______________
(4)D在生产上的用途有____________(写一条).
(5)结构图中的反应包含的基本反应类型有________和___________.(写出其中两种)
查看答案和解析>>
科目: 来源: 题型:
【题目】中兴缺“芯”事件震惊国人。芯片是电脑、智能家庭等的核心部件,芯片的主要成分是纯度极高的硅,其运算速率与硅的纯度有关。
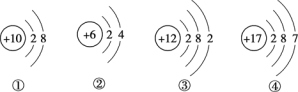
(1)硅与金刚石结构相似,则构成硅的粒子是__________(填粒子名称)。
已知硅原子结构示意图为![]() 下面是四种粒子的结构示意图,其中与硅的化学性质相似的是_______(填序号)。
下面是四种粒子的结构示意图,其中与硅的化学性质相似的是_______(填序号)。
(2)光伏发电的太阳能电池板也需用高纯硅。在日光下高纯硅的作用主要是将光能转化为________能。
(3)自然界中的硅元素主要以二氧化硅的形式存在,请写出二氧化硅的化学式___。硅胶是常用的干燥剂,其主要成分可视作二氧化硅(如图),你认为硅胶可作干燥剂的原因可能是__________(一条即可)。

(4)高纯硅的制备以石英砂(主要成分是二氧化硅)为原料,生产过程示意图如下:

①上述四个步骤中属于物理变化的是_____________。
②物质M是该生产过程中可循环使用的物质,写出步骤4反应的化学方程式_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】我市东临渤海,有着丰富的海洋资源。请思考下列问题:
(1)已知东营盐场测得:①海水中含NaCl约为3.5%。②在海边打深井,井水中含NaCl约为8%。晒盐最好用_____(填序号)作原料。
(2)关于晒盐原理的说法正确的是
A.利用阳光和风力,使水分燕发,析出盐
B.日光照晒后,板化钠的溶解度变小
(3)海水晒盐提取食盐晶体后留下的母液叫卤水,其中含有的KCl、MgCl2、MgSO4等物质可作为重要的化工原料。它们的溶解度曲线如右图所示。
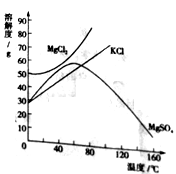
①60℃ 时,将50g硫酸镁加入到100g水中,充分搅拌,所得溶液的溶质质量分数为______,若使其形成饱和溶液,可采取的措施有____。
A.增加溶质 B.蒸发溶剂 C.升高温度 D.降低温度
② 对卤水中含有的KCl、MgCl2、MgSO4三种物质,下列说法正确的是_____
A.三种物质均为易溶物质
B.20℃时,向40gKCl固体和40gMgCl2固体中分别加入100g水充分溶解后,两种溶液均能达到饱和状态
C.60℃时,三种物质溶于水形成的溶液浓度可能相等
查看答案和解析>>
科目: 来源: 题型:
【题目】蚊虫叮咬时,会分泌蚁酸.化学小组同学对蚁酸产生了浓厚的兴趣,决定对其进行探究.
[提出问题]蚁酸的成分是什么?它有什么性质?
[查阅资料]I.蚁酸的化学名称叫甲酸,化学式为HCOOH
II.蚁酸隔绝空气并加热时会分解生成两种氧化物
[实验探究](1)向盛有蚁酸溶液的试管中滴加紫色石蕊试液,观察到溶液颜色变成_____色,说明蚁酸显酸性.
(2)小芳同学根据蚁酸中含有_____元素,推测出蚁酸在隔绝空气并加热分解时生成水.
(3)对它分解生成的另一种氧化物,小敏提出两种猜想:
猜想Ⅰ是CO2;
猜想Ⅱ是_____;
他们按如图所示进行实验:先向装置中通入一会N2,再将蚁酸分解产生的气体通入其中.
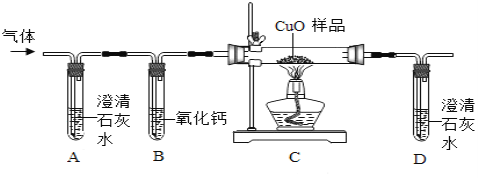
①先通N2的目的是__________;
②若实验过程中看到__________现象,则猜想Ⅰ不成立;
③装置B的作用是__________(用化学方程式表示);
④装置C中的现象为________;
[结论]甲酸受热能分解,反应的化学方程式是_________;
[讨论交流]从环保角度看,该装置存在的明显缺陷是_________.
[拓展延伸]小组同学利用蚁酸分解产生的气体,测定10g氧化铜样品(杂质不参与反应)中氧化铜的质量分数,在不同时刻测定C中固体的质量(如表):
反应时间/min | 2 | 4 | 6 | 8 | 10 |
固体质量/g | 9.3 | 8.8 | 8.5 | 8.4 | 8.4 |
分析表中数据计算:样品中氧化铜的质量分数是多少______?(写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com