
科目: 来源: 题型:
【题目】分析推理是化学学习中常用的思维方法。下列说法正确的是
A. 分子可以构成物质,但物质不一定都由分子构成
B. 盐中含有金属阳离子和酸根离子,![]() 中没有金属阳离子,不属于盐类
中没有金属阳离子,不属于盐类
C. 燃烧一般都伴随发光、放热现象,所以有发光、放热现象的变化就是燃烧
D. 某物质的饱和溶液不能继续溶解该物质,则该饱和溶液也不能继续溶解其它物质
查看答案和解析>>
科目: 来源: 题型:
【题目】右图为元素周期表中钙元素的相关信息及钙原子结构示意图,下列说法不正确的是
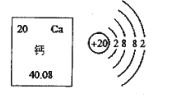
A. 钙原子核内有20个质子
B. 钙的相对原子质量为40.08
C. 钙元素位于元素周期表中的第二周期
D. 钙原子在化学反应中容易失去电子
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化学反应属于复分解反应的是( )
A. 3Fe+2O2![]() Fe3O4
Fe3O4
B. H2CO3=H2O+CO2↑
C. Mg(OH)2+2HNO3=Mg(NO3)2+2H2O
D. 2C2H2+5O2![]() 2H2O+4CO2
2H2O+4CO2
查看答案和解析>>
科目: 来源: 题型:
【题目】日常使用的干电池是一种锌锰电池,它的构造是:负极为锌做的圆筒,正极是一根碳棒,它的周围被二氧化锰,碳粉和氯化铵的混合剂所包围,总称为“碳包”。碳包和锌筒之间填充着氯化铵、氯化锌的水溶液等组成的糊状物。废旧干电池随意丢弃会造成环境污染,学校兴趣小组同学准备对废旧的干电池进行探究。
(一)拆解干电池,得到铜帽、锌皮、碳棒、黑色粉末等物质。
(二)回收二氧化锰并测定碳粉与二氧化锰的质量比:(如图)
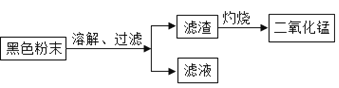
(1)干电池使用时将化学能转化成________能。
(2)上述操作中,灼烧过程中发生的反应用化学方程式表示为__________。
(3)同学们将过滤后得到的滤渣干燥后称得质量为25g,充分灼烧后冷却称得剩余固体质量为20g,则滤渣中二氧化锰与碳粉的质量比为_____,经分析此结果偏大,老师指出同学们在实验中缺少一步操作,该操作是_______________。
(4)为验证二氧化锰,同学们用 A、B两支洁净试管,分别取5mL3%的过氧化氢溶液,往A试管中加入少量上述实验灼烧后得到的固体,如果出现______的现象,说明为二氧化锰,反应的化学方程式为________。
(三)用拆解得到的锌皮(含杂质)制取硫酸锌晶体。实验步骤:
①将剪碎后的锌皮放入烧杯中,加入足量的稀硫酸,充分反应; |
②将上述反应后的混合物过滤; |
③将滤液加热浓缩、_____、过滤,洗涤、低温干燥,得到 ZnSO47H2O 晶体。 |
(5)步骤①中反应方程式为_____________,将锌皮剪碎的目的是_______。
(6)步骤②需要的仪器有铁架台、烧杯、_____和玻璃棒,玻璃棒的作用是_____。
(7)步骤③缺少的操作是_____,洗涤时不能选用_____(填序号)。
A.60℃热水 B.冰水 C.硫酸锌饱和溶液
(四)测定锌皮中锌的质量分数。同学们设计了如图实验装置,取 1g 锌皮放于试管中, 实验中将注射器内40毫升稀硫酸(足量)完全注入试管中。当试管中不再产生气泡时立刻读数得到量筒中水的体积为264毫升。已知实验条件下氢气的密度为0.09g/L。
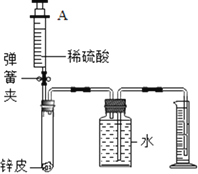
(8)计算该锌皮中锌的质量分数_____。
(9)上述方法测得的锌的质量分数偏大,可能的原因是_____(填序号)。
A.未等装置完全冷却就读数
B.锌皮中含有少量铁
C.试管中有气体没有排出
D.将注射器中稀硫酸全部注入试管中后忘掉夹紧弹簧夹
查看答案和解析>>
科目: 来源: 题型:
【题目】食盐是生活必需品,是重要的化工原料,也是同学们实验时常用的药品。
(1)食盐中含有各种添加剂,如添加碘酸钾(KIO3)补充碘元素、添加亚铁氰化钾(K4[Fe(CN)6]3H2O)作为抗结剂防止食盐结块。
①食盐中至少含有_____________种金属元素(填数字)。
②亚铁氰化钾中的金属离子是 K+和____________(填微粒符号)。
(2)电解饱和食盐水可以得到多种化工产品,主要过程如下:
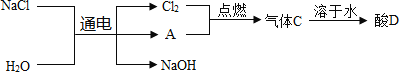
①若气体A 是一种单质,则该气体为__________,你猜想的依据是_____________。
②电解生成氢氧化钠的化学方程式为_____________。
③酸D溶液中溶质的化学式为_________________。
(3)如图是实验室配制一定溶质质量分数的氯化钠溶液的流程图。
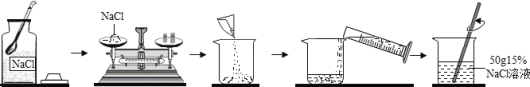
请回答:
①应称量____________g氯化钠固体,需加水_____________mL。
②若称量氯化钠固体时指针向右偏转,则应______________直到天平平衡。
③实验中发现氯化钠固体已结块,为了较快地溶解,合理的方法有_____________(填序号)。
A.用玻璃棒将氯化钠固体捣碎 B.用热水溶解
C.加入更多的水 D.用玻璃棒搅拌
④下列操作中可能导致配制氯化钠溶液的溶质质量分数偏小的是___________(填序号)。
A.氯化钠中含有杂质 B.量取水时仰视
C.用已有少量水的烧杯溶解氯化钠 D.转移时,有少量溶液溅出
⑤取上述溶液10g,需加______________g水稀释,可得到5%的氯化钠溶液。
查看答案和解析>>
科目: 来源: 题型:
【题目】人类对金属的开发和利用是循序渐进的。
(1)青铜器是人类较早使用的金属制品。西汉时期,人们主要采用“湿法冶金”。如将铁浸入硫酸铜溶液中,该反应的化学方程式为________________。

(2)随着技术的不断进步,人们能利用还原剂从金属的氧化物中将其还原出来。例如, 高炉炼铁所涉及的物质转化过程如下:
![]()
其中焦炭作用是:①产生高温;②________(用化学方程式表示),A与赤铁矿中的氧化铁反应的化学方程式为__________。
(3)取制得的生铁样品 5.8g放入100g7.3%的稀盐酸中,恰好完全反应,则生成氢气的质量为______g、得到的溶液中溶质质量分数为________(结果保留至 0.1%)。
(4)每年因为腐蚀(如铁生锈)而报废的金属相当于年产量的20%~40%,人们采用多种方法防止金属腐蚀。铁在空气中锈蚀,实际上是铁跟空气中的________共同作用的结果,为了防止钢铁锈蚀,人们常采用的防止锈蚀的方法有__________(写出一条即可)。
(5)铝的金属活动性比铁_____(填“强”或“弱”),但铝制品却具有比较好的抗腐蚀性能,其原因是_____(用化学方程式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】水是由氢、氧两种元素组成的化合物,这一结论是科学家们在大量实险的基础上得出的。
(资料)(1)碱石灰的主要成分是氢氧化钠(NaOH)和氧化钙(CaO),可吸水,并与二氧化碳反应;
(2)同温同压下,气体的体积比等于分子数比。
(1)研究氢气的燃烧实验是人们认识水组成的开始。
①氢气在点燃前一定要_____。
②在相同条件下,欲使1L氢气完全燃烧,所需空气至少约为_____L。
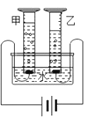
(2)科学家们又用“电解法”证明了水的组成(如图),该反应的化学方程式为_____________。电解时,水中需加入少量稀硫酸或氢氧化钠溶液,其作用是___________。通电一段时间后, 量筒乙中收集到的气体是____________(填物质名称),若发现甲、乙两量筒中收集的气体体积比略小于 1:2,其原因可能是___________________(写出一条即可)。
(3)拉瓦锡还用另一实验证明了水的组成。他让水蒸气通过一根烧红的铁质枪管,结果得到了氢气,同时枪管表面有黑色固体(磁铁矿的主要成分)生成。该反应的化学方程式为_____________。
(4)用“氢气还原氧化铜”实验也可以证明水的组成(如图)。
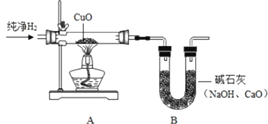
①如图连接实验装置、检查装置的气密性、装药品、固定实验装置后,主要实验步骤有: a.通入氢气;b.点燃酒精灯;c.熄灭酒精灯;d.停止通入氢气。其中,先通氢气后点燃酒精灯的目的是__。
②硬质粗玻璃管中发生的现象是_________;反应的化学方程式是_________。
③装置 A 中的玻璃管和其中物质在反应前后的质量差为 m1,装置 B 和其中物质在反应前后的质量差为m2,据此可计算出水中 H、O 元素的质量比为_____________(用含 m1、m2 的代数式表示)。实验时,该比值往往略大于1:8,原因可能是_____(填序号)。
A.氢气中含有水蒸气
B.装置A 中生成的铜又部分被氧化
C.空气中的水蒸气、二氧化碳等进入装置 B 中
D.有少量水蒸气液化残留在硬质玻璃管中
查看答案和解析>>
科目: 来源: 题型:
【题目】请根据下图所示的实验装置图填空。
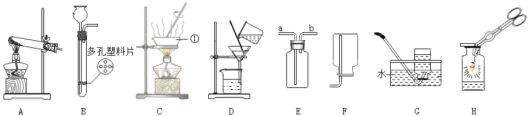
(1)仪器①的名称是_________;
(2)实验室用 A 装置制取氧气,该反应的化学方程式为_____,若要收集较为纯净的氧气,收集装置应选用______(填序号)。如图H,将红热的铁丝伸入盛满氧气的集气瓶中,化学方程式为____。
(3)实验室制取二氧化碳常选用的发生装置是_______(填序号),该反应的化学方程式为_______ ,该装置的优点是_______。收集装置若选 E,用排空气法收集气体,则气体应从_____(填“a”或“b”)端进入。反应结束,要从反应后的混合物中得到氯化钙固体需要用到上述的_______装置(填序号)。
(4)下图是二氧化碳制备和性质的微型实验装置图。
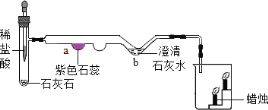
试管中反应发生后,a处的实验现象是_____________,b处的化学方程式是____________,烧杯中的实验现象是______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】分解水制氢的一种原理如图。下列关于该原理的说法正确的是
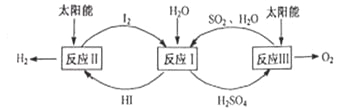
A. 反应过程中化合价改变的元素有H、O、S、I
B. 涉及的反应类型有分解反应和化合反应
C. 理论上,每生成16 g O2,就能得到2gH2
D. 理论上,每分解18g H2O,就需向体系内再补充32 gSO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com