
科目: 来源: 题型:
【题目】足量蜡烛(由碳、氢元素组成)在密闭集气瓶内(起始时常压)燃烧至熄灭.瓶内氧气体积分数随时间变化如图所示.下列说法正确的是( )
①起始阶段蜡烛燃烧比在空气中燃烧剧烈
②燃烧过程中,瓶内物质总质量不变
③蜡烛熄灭是由于瓶内氧气浓度过低
④若产物中二氧化碳与水分子个数相等,则反应后瓶内气体总质量增加.
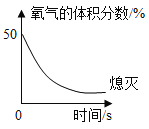
A.③④ B.①②③
C.①②④ D.①②③④
查看答案和解析>>
科目: 来源: 题型:
【题目】碳酸钠在轻工、建材、纺织、国防、医药等工业中有重要的应用,我国化学家侯德榜创立了著名的“侯氏制碱法”,促进了世界技术的发展。
(查阅资料)①生产原料粗盐中含有少量可溶性杂质(MgCl2 和 CaC12)及不溶性杂质。
②氨气极易溶于水,二氧化碳能溶于水。
③生产原理:NaCl + NH3 + CO2+ H2O = NaHCO3↓+ NH4C1,分离得晶体 A,并使其充分受热,可分解制得纯碱及两种常见的氧化物。
④氯化铵分解的化学方程式是 NH4Cl===NH3↑+HCl↑。
⑤部分生产流程如下图所示:
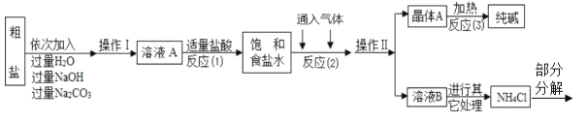
(问 题讨论)
(1)溶液 A 中的溶质为 ________,流程中加入适量盐酸的作用是 ________。
(2)反应(2)中为提高产率,所通入气体的顺序是 ________(填字母序号).
A.先通入 CO2 再通入 NH3 B.先通入 NH3 再通入 CO2
(3)上述生产流程中可循环使用的是 ________(填序号).
A.CO2 B.NH3 C.HCl D.NaOH E.Na2CO3
(组成确定)
(1)称取一定质量的纯碱样品,多次充分加热,称重,质量无变化;
(2)另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀 HNO3,再滴加 AgNO3溶液,有白色沉淀。由上述实验可确定纯碱样品含有杂质 ________(写化学式).
(含量测定) 同学们为了测定该纯碱样品的纯度(假定只含一种上述杂质),设计了如下三组实验。甲组:取 12.0g 纯碱样品,向其中加入过量的盐酸,直至样品中无气泡冒出。将反应所得溶液小心蒸发,并将所得物质干燥、冷却至室温称得固体质量为 13.1g.样品中碳酸钠的质量分数为________。
乙组:取 12.0g 纯碱样品,利用下图所示装置,测出反应装置 C 增重了 4.1g(所加试剂均足量,每一步都反应完全).实验结束,发现乙组测定的质量分数偏小,其原因是_________。
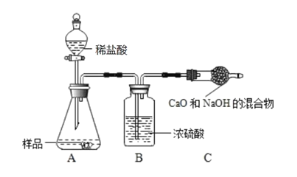
丙组:取 12.0g 的纯碱样品,完全溶于水,向其中加入过量的氯化钙溶液,待完全沉淀过滤、 洗涤、烘干称量固体质量,从而计算出碳酸钠的质量分数。组内同学提出意见,认为如果将氯化钙溶液换成氯化钡溶液则更好,老师认为有道理,原因是 ________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是实验室制取气体的部分装置,请回答下列问题:

(1)仪器名称:① ________,② ________。
(2)用氯酸钾和二氧化锰制取并收集一瓶干燥氧气,可选用装置 ________(选填序号), 二氧化锰的作用是 ________,选用 B 装置制氧气的化学方程式为 ________。
(3)实验室制取 CO2 的化学方程式为 ________,若将发生装置由 B 改为 C, 其优点是________。
(4) SO2 是无色有刺激性气味的有毒气体,密度比空气大,其化学性质与 CO2 相似。用上图中 FGH 的组合收集一瓶干燥的 SO2,装置中导管按气流方向连接顺序是①→②→_______→_______→⑤(填序号);烧杯中 NaOH 溶液的作用是 ________(用化学方程式表示),漏斗的作用是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学实验是科学探究的重要途径,请根据下列实验图示回答相关问题:
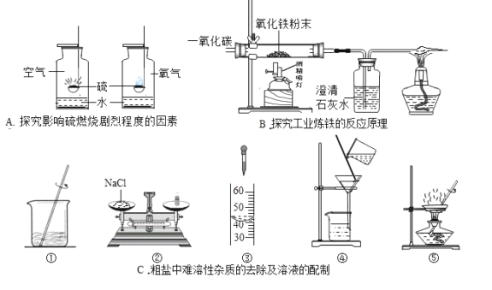
(1)A 实验中分别将硫在空气和氧气中燃烧,硫在氧气里燃烧比在空气里燃烧更剧烈,说明了硫燃烧剧烈程度和 ________相关。
(2)B 实验中,硬质玻璃管中反应的化学方程式 ________;装置末端酒精灯的作用是________.
(3)C 实验中,若要除去粗盐中难溶性的杂质,其正确操作步骤为 _________填序号), 步骤⑤中玻璃棒的作用是 ________;若按照②③①的步骤配制 50gl6%的氯化钠溶液,需要水的体积________(水的密度为 1g/mL)。若某同学所配溶液的溶质质量分数偏大,其原因可能是 ________ (填序号)。
A、称量时,砝码生锈,氯化钠质量偏大 B、氯化钠固体不纯
C、量取水时,俯视读数 D.装瓶时,有少量溶液洒出
查看答案和解析>>
科目: 来源: 题型:
【题目】烧杯盛有一定质量的碳酸钾和碳酸钙的固体混合物,向其中加入20g 的稀盐酸,恰好完全反应,将气体通入足量澄清石灰水中(气体全部被吸收),过滤,测得溶液质量减少2.8g。则所用稀盐酸的溶质质量分数是 ( )
A. 7.3%B. 18.25%C. 14.6%D. 23.2%
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图象不能正确反映其对应关系的是 ( )
A. 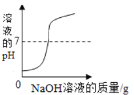 向稀盐酸中不断滴加氢氧化钠溶液
向稀盐酸中不断滴加氢氧化钠溶液
B. 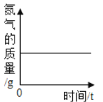 红磷在装有空气的集气瓶中燃烧
红磷在装有空气的集气瓶中燃烧
C.  向二氧化锰中不断滴加过氧化氢溶液;
向二氧化锰中不断滴加过氧化氢溶液;
D. 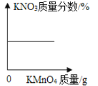 向饱和硝酸钾溶液中加入高锰酸钾固体。
向饱和硝酸钾溶液中加入高锰酸钾固体。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是以空气和其他原料合成 NH4NO3 的工业流程,下列说法不正确的是 ( )
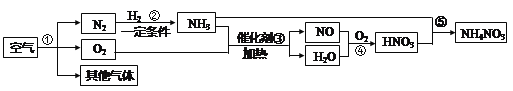
A. ①中所得“其他气体”中稀有气体含量最高
B. 上述流程中涉及到的化合反应有 3 个
C. ④中参加反应的 O2 和 H2O 的质量之比 16:9
D. 理论上,若③和⑤中 NH3 的量相同,则合成 NH4NO3 时氨气的利用率最高
查看答案和解析>>
科目: 来源: 题型:
【题目】用10g含杂质的高锰酸钾样品制取氧气,充分加热至固体质量不在改变时,称量固体质量为9.04g。(杂质不参与反应)求:
(1)反应中产生氧气的质量是多少_______?
(2)参加反应的高锰酸钾的质量是多少_______?
(3)若要制取4.8g氧气需要多少克该样品_______?
查看答案和解析>>
科目: 来源: 题型:
【题目】蛋白质在人体胃肠内与水反应,最终生成氨基酸被人体吸收。丙氨酸(化学式为C3H7O2N)就是其中的一种。请回答下列问题:
(1)丙氨酸分子中,碳、氢、氧、氮四种原子的个数比是_____。
(2)丙氨酸的相对分子质量是_____。
(3)氮元素质量分数是_____。
(4)89g谷氨酸中的氮元素与_____g尿素[CO(NH2)2]中所含的氮元素相等。
查看答案和解析>>
科目: 来源: 题型:
【题目】为了研究质量守恒定律,某兴趣小组设计了如图1白磷燃烧前后质量测定”的实验,请分折有关问题。
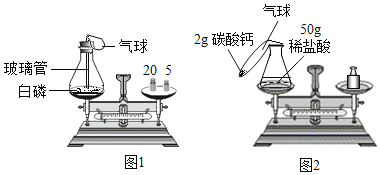
(1)装置:锥形瓶的底部铺有一层细沙,其作用是_____。
(2)燃烧前称量,锥形瓶的总质量为27.6g,则如图托盘天平中游码读数为_____g。
(3)白磷燃烧:白磷燃烧过程中看到的现象是_____,气球的变化是_____。
(4)燃烧后称量:发现托盘天平指针偏向右边,造成这种现象的原因可能是_____(只写一条)。
(5)反思:白磷燃烧_____(填“遵守”或“不遵守”)质量守恒定律,理由是_____。
考虑到白磷的危险性,老师改进了本实验,确定以“稀盐酸与碳酸钙反应“为研究对象,设计的实验装置如图所示。(方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑)
(6)实验步骤如下:
①按如图2方式放好仪器,使天平平衡。
②将碳酸钙粉末全部倒入锥形瓶中,观察到锥形瓶中液体里出现的现象是_____。
③当反应结束时,气球已经完全鼓起,小明发现天平的指针已经向右偏了。他感到困惑:其他操作和仪器装置均正常。实验现象与数据与预测结果不符的原因是_____。
(7)本实验需要称量什么?_____,称量几次?_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com