
科目: 来源: 题型:
【题目】草酸存在于自然界的植物中。草酸晶体(H2C2O42H2O)无色,易溶于水,于100℃开始失水,熔点 101.1℃,加热会熔化和分解(分解温度为 157℃以上),同时易升华(起始升华温度为 100℃),草酸能与氢氧化钙反应生成白色沉淀: H2C2O4+Ca(OH)2 === CaC2O4↓+2H2O 。
请回答下列问题:
(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物。
①a 仪器的名称是___________________________;
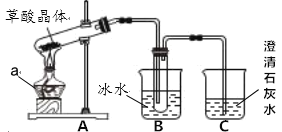
②装置 A 中试管管口向上倾斜的原因是:________;
③装置 B 的主要作用是______________;
④装置 C 中澄清石灰水变浑浊,由此可知草酸晶体分解的产物中一定有___________________________。
(2)乙组同学认为草酸晶体分解的产物中还有 CO。为进行验证,选用甲组实验中的装置 A、B 和如图所示的部分装置(可以重复选用)进行实验。
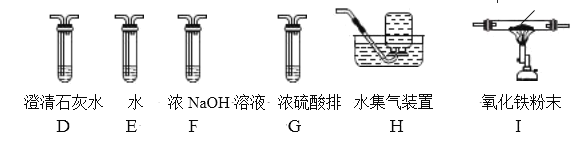
①乙组同学的实验装置依次连接的合理顺序为:
A→B→(___________)→(____________)→(_________________)→I→D→H。
②装置 I 中盛有的氧化铁发生了颜色变化,欲证明草酸晶体分解的产物中有 CO, 乙组同学需要两次使用装置 D,第一次 D 中现象__________________,第二次D 中现象___________________________。
查看答案和解析>>
科目: 来源: 题型:
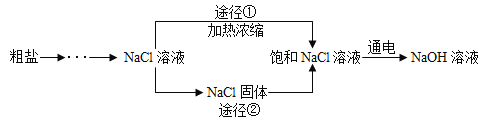
【题目】某同学设计的工业制备氢氧化钠的流程如图。
资料:①2NaCl + 2H2O![]() 2NaOH + H2↑+ Cl2↑,电极一端得到 NaOH 和 H2, 另一端得到Cl2。
2NaOH + H2↑+ Cl2↑,电极一端得到 NaOH 和 H2, 另一端得到Cl2。
②Cl2 用于生产 84 消毒液,其反应原理为:Cl2 + 2NaOH = NaCl + NaClO + H2O
(1)晾晒海水得到粗盐的原理是_________。
(2)实验室蒸发用到的仪器材料有铁架台、坩埚钳、石棉网、玻璃棒、酒精灯和______________。
(3)工业生产中应选择途径___________________获得饱和 NaCl 溶液。
(4)84 消毒液有效成分 NaClO 中氯元素的化合价为______________。
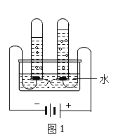
(5)图 1 实验探究水的组成,不能加入NaCl 增强水的导电性的理由是_____________;电解水的化学方程式___________________________________。
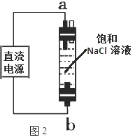
(6)图 2 实验获得 84 消毒液,直流电源正极应与______________ (填 a 或 b)连接, 才能使 NaClO 的含量更高。
查看答案和解析>>
科目: 来源: 题型:
【题目】2019 年政府工作报告中提出今年工作重点之一是加强污染防治和生态建设,大力推动绿色发展,要求 SO2、NOx 排放量下降 3%。工业上常用 NaOH 溶液来吸收二氧化硫以达到防治污染的目的。
(1)酸雨的 pH_________5.6(填“<”、“=”或“>”),危害性大。地球不想吃“酸”, 请你写出一条防治酸雨的做法:____________。
(2)如图是喷淋塔吸收二氧化硫的图示
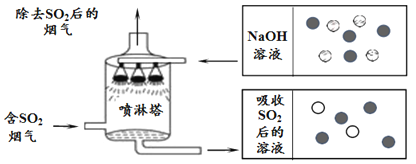
①吸收过程用氢氧化钠溶液喷淋 SO2,而不是 SO2 直接通入氢氧化钠溶液是为了_______________。
②写出 NaOH 溶液吸收 SO2 的化学方程式__________________。
③上图中小球分别表示 NaOH 溶液及吸收 SO2 后所得溶液中溶质的微粒,其中“ ![]() ”表示的微粒是_____________(填符号)。
”表示的微粒是_____________(填符号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是实验室制取气体的常用仪器。请根据要求填空:
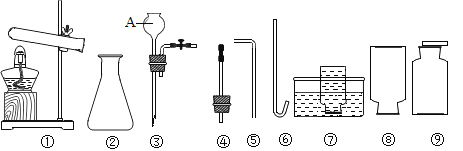
(1)图中仪器名称是⑧___________________________。
(2)小宝同学用氯酸钾和二氧化锰制取并收集一瓶干燥的氧气,应选择上图中的仪器________________(填序号,下同),其化学方程式为:______________________; 验证瓶中氧气已集满的方法是___。
(3)小茹同学用锌和稀硫酸制取 H2,则应选择图中仪器___________组成发生装置, 其化学方程式为:_____________________。
(4)小佳同学查阅资料得到制取硫化氢气体的如下信息,请回答下列问题:
气体 | 实验药品 | 反应条件 | 气体物理性质 |
H2S | 硫化亚铁固体与稀硫酸 | 不需加热 | 无色,密度比空气大,可溶于水 |
①制取 H2S 时不选择发生装置_____________(填代号),理由是_______________________。
②收集 H2S___________________________(填“可以”或“不可以”)采用仪器⑥和⑦组成收集装置。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学配制 50 g 9%的氯化钠溶液,整个操作过程如图所示,回答下列问题:

(1)配制溶液的正确操作顺序为__________(填序号,后同),其中操作错误的是__________。
(2)该实验中所需食盐的质量是______________________。
(3)量水时选用的量筒的量程最合适的是____________(填字母),读数时视线要与量筒内_________________保持水平。
A 10 mL B 25 mL C 50 mL D 100 mL
查看答案和解析>>
科目: 来源: 题型:
【题目】归纳是学习的重要方法。学完盐的性质后,小郑归纳出酸的 A、B、C、D、E 五条化学性质,并用“五角星”呈现出来,见下图:
(1)图中酸的 D 性质中,即“五角星”右下角里面对应物质的类别是____________;

(2)紫色石蕊试液滴入酸中,溶液显_____________色;
(3)若酸是硫酸,请写出用稀硫酸清除铁锈的主要反 应化学方程式:________________;
(4)若酸是盐酸,请你选择一种常见的物质来检验酸 的 D 性质___________________(填化学式);
(5)小郑探究 Mg 和 Fe 与酸液反应的快慢,需要控制的变量是______________________(填代号)。
①金属的聚集形态(形状);②酸液起始温度;③酸液种类;④酸液的浓度;⑤反应容器的大小
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为四种物质的溶解度曲线。向Na2Cr2O7溶液中加入适量KC1,经蒸发浓缩,冷却结晶,过滤之后得K2Cr2O7固体,下列有关说法错误的是( )
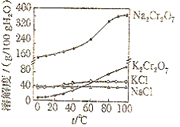
A. 上述过程中涉及的化学反应属于复分解反应
B. 80℃时100g四种溶液中,溶质质量分数最小的是NaCl溶液
C. 上述冷却结晶过程中,冷却到10℃时得到的K2Cr2O7固体比60℃时多
D. 在0﹣100℃时,相同温度下,四种物质中溶解度最大的均是Na2Cr2O7
查看答案和解析>>
科目: 来源: 题型:
【题目】“愚人金”实为铜锌合金,外观与黄金极为相似,常被不法商贩冒充黄金牟取暴利,下列关于鉴别“愚人金”与黄金的实验方案,合理的是![]()
![]()
![]() 比较硬度,硬度小的是“愚人金”
比较硬度,硬度小的是“愚人金”
![]() 灼烧,表面变色的是“愚人金”
灼烧,表面变色的是“愚人金”
![]() 浸没在稀硫酸中,表面有气泡产生的是“愚人金”
浸没在稀硫酸中,表面有气泡产生的是“愚人金”
![]() 浸没在硫酸锌溶液中,表面附着白色物质的是“愚人金”
浸没在硫酸锌溶液中,表面附着白色物质的是“愚人金”
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】为验证“加热碳酸氢铵”所发生的变化,小郑设计如图所示的装置进行实验,实验过 程观察到碳酸氢铵固体消失,无水硫酸铜变蓝,浸有酚酞试液的棉球变红,澄清石灰水变浑浊。关于该实验,下列说法错误的是(温馨提示:无水硫酸铜为白色固体,遇水变蓝。)
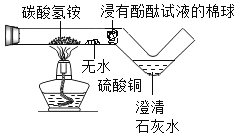
A. 实验中棉球变红,说明生成 NH3
B. 该实验能体现环保的设计思想
C. 该实验设计复杂,只需把碳酸氢铵直接放于蒸发皿加热,固体消失可证明发生分解
D. 加热碳酸氢铵可发生反应:NH4HCO3 ![]() NH3↑+CO2↑+H2O
NH3↑+CO2↑+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】某石化厂有一种石油产品含有质量分数为4.9%的残余硫酸,过去他们都是用NaOH溶液来清洗这些硫酸。请你计算:
(1)若要清洗1000kg的这种石油产品,需要_____kg的NaOH。
(2)该石化厂进行了技术改造,采用Ca(OH)2中和这些残余硫酸。每处理1000kg这种产品,他们可以节约多少经费_____?请你写出具体的计算过程。工业级的NaOH和Ca(OH)2的最新市场批发价如下表:
试剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 1.00 | 6.00 |
(3)请你在图中画出氢氧化钠和氢氧化钙处理1000kg该石油产品时,残余硫酸溶质的质量变化曲线;氢氧化钠用虚线表示,氢氧化钙用实线表示。_____(请你注明具体的坐标)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com