
科目: 来源: 题型:
【题目】下列图像能正确反映其相应变化过程的是
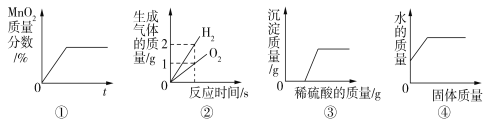
A. 图①表示实验室用KClO3与MnO2共热制O2
B. 图②表示将水通电电解一段时间
C. 图③表示向一定量的氢氧化钠和氯化钡的混合溶液中滴加稀硫酸
D. 图④表示一定质量的稀硫酸中不断加入氧化铜固体
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为甲、乙两种固体物质的溶解度曲线,下列说法正确的是( )
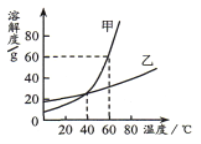
A. 200C时,甲物质的溶解度比乙物质的溶解度大
B. 甲物质中混有少量乙物质,采用蒸发结晶的方法提纯甲物质
C. 400C时,甲、乙两种物质的饱和溶液中溶质质量分数相等
D. 600C时,将80g甲物质放入100g 水中,所得溶液中溶质质量与溶剂质量之比是 4:5
查看答案和解析>>
科目: 来源: 题型:
【题目】稀硫酸是一种重要的化学试剂,现用10g 98%的浓硫酸配制10%的稀硫酸,请回答下列问题:
(1)实验的主要步骤有:计算、____________、配制、装瓶并贴标签。
(2)由计算可知,稀释时需加水______________mL(水的密度为:1g/ mL),取水时选用量筒的量程最合适的是_______________(填序号)。
A.25mL B.50mL C.100mL D. 250mL
(3)实验所需要的玻璃仪器有量筒、胶头滴管、烧杯、_______________和试剂瓶。
(4)某课外活动小组为测定某铜锌合金中铜的质量分数,取合金样品10g放入烧杯,向其中逐渐加入10%的稀硫酸,所加稀硫酸与生成氢气质量的关系如图所示。计算:
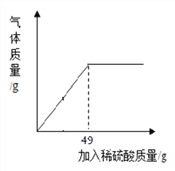
①完全反应后,产生氢气的质量为________g;
②样品中铜的质量分数为___________;(写出计算过程)
查看答案和解析>>
科目: 来源: 题型:
【题目】甲、乙两同学对镁与盐酸反应进行系列研究。
甲、乙两同学取一根镁条,首先用砂纸打磨除去_______,观察到镁条的颜色_______。
研究Ⅰ:镁与盐酸反应过程中的能量变化以及反应速率的变化。
(1)反应中试管外壁发烫,说明镁与稀盐酸反应是_______反应(填“吸热”或“放热”),反应的化学方程式是________。
(2)实验测得镁片产生气体的速率(v)与时间(t)的关系如图所示,
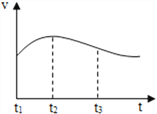
则t1-t2内反应速率逐渐加快的主要原因是________;
反思:t2-t3内反应速率逐渐减慢的主要原因是_________;
研究Ⅱ:反应后所得溶液的酸碱性探究。
(3)用pH试纸测定反应后所得溶液的酸碱度,发现pH略小于7。
甲同学:猜想Ⅰ:稀盐酸过量;猜想Ⅱ:氯化镁溶液呈弱酸性。
用pH试纸测定酸酸碱度的方法是_______。为验证猜想Ⅱ正确,可以通过查阅资料,也可以取纯净的________溶液并测定其酸碱度。
(4)乙同学将镁片(有剩余)投入适量稀盐酸,待不再产生气泡时立即测量pH,却发现所得溶液pH大于7,溶液冷却到室温后pH小于7。查阅资料发现①Mg+2H2O=Mg(OH)2↓+H2↑,②20℃时SMg(OH)2=0.009g,80℃时 SMg(OH)2=0.0108g。根据资料,乙同学实验中pH发生变化的原因是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据所学知识并结合下列仪器,回答有关问题
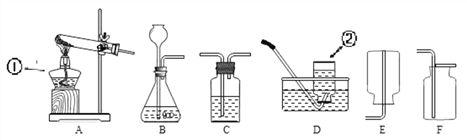
(1)写出对应仪器的名称:①_________________ ②___________________。
(2)实验室加热高锰酸钾制取并收集一瓶较纯净的氧气,应选择的装置组合是_____(填序号),该反应的化学方程式______;若收集的氧气不纯,其可能原因有________(填一种即可)。
(3)常见气体发生装置除了固体加热型和固液不加热型之外,还有固液加热型等。下图G装置是用铜和浓硫酸反应的实验装置
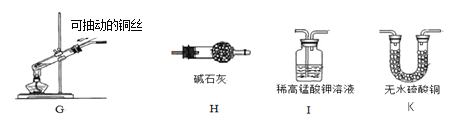
①反应原理:Cu + 2H2SO4(浓) △______+ SO2↑ + 2H2O
②G装置中将铜丝设计为可抽动,是为了控制___________________。
③生成物中的SO2是一种空气污染物,它会导致_____________(填一种空气污染名称)。
④若要验证生成物中有SO2和水蒸气,请从H、I、K中选择合适的装置序号填空:G →____→___________→尾气处理装置。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学用语是学习化学的重要工具。请按要求用化学用语填空:
①2 个铜原子_____。
②5 个氢氧根离子_____。
③最理想、清洁能源的气体单质_____。
④氧化铝中铝元素的化合价为+3 价_____。
⑤一种通常用于改良酸性土壤的物质_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是a、b、c三种不含结晶水的固体物质的溶解度曲线,下列说法中正确的是( )
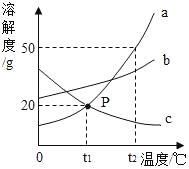
A. a的溶解度比c大
B. t1℃时,a的饱和溶液中溶质与溶液的质量比为1:5
C. t1℃时,a、c的两种饱和溶液中溶质的质量分数相等
D. 将t2℃a、b的两种饱和溶液分别降温至t1℃,析出a的质量一定比析出b的质量大
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学小组同学利用盐酸和氧化铜进行实验的过程中,出现了意想不到的现象:发现溶液变为了绿色。 为探究溶液变绿的原因,进行系列实验。
(查阅资料)①氧化铜(CuO)为黑色固体②铜离子(Cu2+)在水溶液中呈蓝色
(进行实验)
实验 1:取 2mL 不同浓度的盐酸分别加入到盛有 0.2g 氧化铜的试管中,进行实验。
序号 | 浓盐酸与水的 体积比 | 现象 |
1-1 | 1:1 | 30 秒后溶液变为绿色,无黑色固体剩余 |
1-2 | 1:2 | 1 分钟后溶液变为蓝绿色, 无黑色固体剩余 |
1-3 | 1:3 | 2 分钟后溶液变为蓝色,无黑色固体剩余 |
1-4 | 1:4 | 4 分钟后溶液变为浅蓝色,有黑色固体剩余且不再减少 |
实验 2:取 2mL 稀盐酸(浓盐酸与水的体积比为 1:3)加入到盛有 0.2g 氧化铜的试管中,实验装置如下。
序号 | 2-1 | 2-2 |
操作 |
|
|
现象 | 2 分钟后溶液变为蓝色,无 现象黑色固体剩余 | 10 秒后溶液变为浅绿色,无 黑色固体剩余 |
(解释与结论)
(1)补全氧化铜与盐酸反应的化学方程式:CuO+2HCl ==== CuCl2+_________________
(2)实验 1 中配制不同浓度的盐酸时,需要使用的仪器包括______________________(填序号,下同)。
A 量筒 B 烧杯 C 酒精灯 D 玻璃棒
(3)实验 1 的目的是_______________。
(4)结合实验 1 和实验 2,得出的结论是______________________。
(反思与评价)
(span>5)实验 1-4 中,“有黑色固体剩余”的原因是___________________。
(6)实验 1 中若进行浓盐酸与水的体积比为 1:5 的实验,充分反应后可能出现的现象为 ______________。
A 溶液变为绿色,无黑色固体剩余
B 溶液变为更浅的蓝色,无黑色固体剩余 C.溶液变为更浅的蓝色,有黑色固体剩余
查看答案和解析>>
科目: 来源: 题型:
【题目】氨法脱硫可防治二氧化硫(SO2)污染,同时制得化肥(NH4)2SO4。主要流程如下:
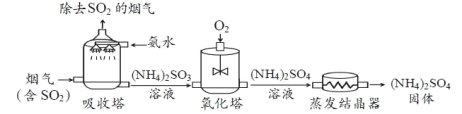
(1)吸收塔中,氨水采用喷淋方式注入,其目的是____________。
(2)吸收塔中发生的反应为:2NH3 + H2O + SO2 ==== (NH4)2SO3,若利用此反应吸收 64kg 二氧化硫,则参加反 应的氨气(NH3)的质量为_____________________kg。
(3)氧化塔中通入氧气的目的是将(NH4)2SO3 转化为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com