
科目: 来源: 题型:
【题目】如图是初中化学中常见物质间的转化关系,其中甲、乙、丙为单质;A、B、C、D、E为化合物,且A与B的组成元素相同,D与E的组成元素也相同。已知C、丙均为黑色粉末,C和E在高温条件下可生成丙和D,其余反应条件、部分反应物和生成物均已略去。试推断:

(1)写出有关物质的化学式:
A:_____、B:_____、乙:_____;
(2)写出下列化学方程式:
甲→C:_____;
C+E→丙+D:_____。
(3)写出D物质对环境有利与有害的两面_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知NaHCO3在270℃时完全分解为碳酸钠、水和二氧化碳,而Na2CO3受热不分解.现有某工厂生产出的一批NaHCO3产品中混有少量的Na2CO3,某兴趣小组同学为了测定该产品中NaHCO3的质量分数,设计了下列两种实验方案.
方案一:样品![]() 测定生成CO2的质量.
测定生成CO2的质量.

(1)本实验采用如图所示的装置,C中盛放的物质是 .
(2)若把分液漏斗中的稀硫酸改为稀盐酸,在其他操作正确的情况下, (填“能”或“不能”)准确测定样品中NaHCO3的质量分数.
方案二:样品![]() 测定剩余固体质量.
测定剩余固体质量.
具体操作步骤如下:
①一只洁净的坩埚,称得质量为21.2克,再向其中加入样品,称得总质量为41.2克;
②加热盛有样品的坩埚;
③将坩埚充分冷却,称量坩埚和剩余固体的质量;
④多次重复步骤②和③至恒重,称得坩埚和剩余固体的总质量为35.0克.
(3)实验时需要重复“加热、冷却、称量”操作多次,其目的是 .
(4)根据题意,计算样品中NaHCO3的质量分数,写出计算过程.
(已知2NaHCO3![]() Na2CO3+H2O+CO2↑)
Na2CO3+H2O+CO2↑)
查看答案和解析>>
科目: 来源: 题型:
【题目】现有实验室制取气体的部分装置如图1,请结合所学知识,回答下列问题。
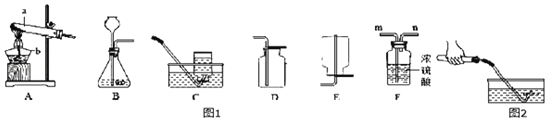
(1)请写出图中标有字母的仪器名称:a_____,b_____。
(2)小蕊想节省药品的同时慢慢地制取二氧化碳,她应该选择发生装置_____,并且装置还需做改动的是_____,请写出该反应的化学方程式:_____。
(3)实验室用氯酸钾制取氧气,可用的发生装置是_____,请写出反应的化学方程式:_____,
(4)实验室制取氢气的化学方程式为:_____,常用的发生和收集装置是_____,若要收集到干燥的氢气,应将发生装置与F装置的_____(填“m”或“n”)相连。
查看答案和解析>>
科目: 来源: 题型:
【题目】南昌大学研发的“硅衬底高光效GaN基蓝色发光二极管技术”获得2015年国家技术发明一等奖。请回答下列问题:
(1)右图是镓在元素周期表中的信息以及原子结构示意图。
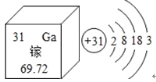
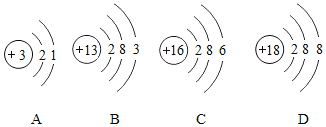
镓的相对原子质量为 ;下列原子结构示意图所对应的元素与镓元素的化学性质相似的是 (填序号);
(2)氮化镓(GaN)中镓元素的化合价为+3价,则氮元素的化合价为 价;
(3)传统制备氮化镓的化学原理是:GaCl3+NH3![]() GaN+3X ,其中X的化学式为 。
GaN+3X ,其中X的化学式为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列4个图象分别代表对应的4种过程,其中正确的是( )
A. 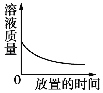 敞口放置于空气中的浓硫酸或浓盐酸
敞口放置于空气中的浓硫酸或浓盐酸
B. 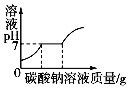 向含有盐酸的CaCl2溶液中滴加Na2CO3溶液
向含有盐酸的CaCl2溶液中滴加Na2CO3溶液
C. 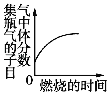 少量的炭在密闭的集气瓶中与氧气完全燃烧
少量的炭在密闭的集气瓶中与氧气完全燃烧
D. 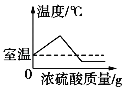 将浓硫酸加入水中
将浓硫酸加入水中
查看答案和解析>>
科目: 来源: 题型:
【题目】石灰石在生产生活中有广泛的用途。
(1)工业上煅烧石灰石可制得活性CaO。为测定不同煅烧温度对CaO活性的影响,取石灰石样品分为三等份,在同一设备中分别于800℃、900℃和1000℃条件下煅烧,所得固体分别与等质量的水完全反应,测得反应液温度随时间的变化如图所示。下列说法错误的是_____
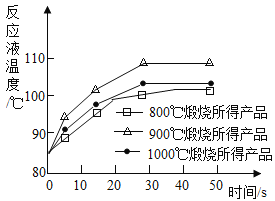
A CaO与水反应会放出热量
B 实验中涉及到的反应类型有分解反应和置换反应
C 由图可知,800℃煅烧所得CaO活性最高
D 要得出正确结论,煅烧时还需控制的条件是煅烧的时间相同
(2)工业用石灰石浆吸收废气中的二氧化硫,并制取石膏(主要成分为硫酸钙)。简易流程如下图,主要的反应为:2CaCO3+2SO2+O2==2CaSO4+2X。请回答下列问题:
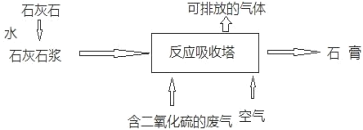
①反应中X的化学式为_____,硫元素的化合价在反应前后的变化为_____。
②减少二氧化硫的排放,主要为了_____(填序号)。
A 减缓温室效应 B 减少酸雨形成 C 防止破坏臭氧层
③请你列式计算:按上述方法处理2000吨废气中的二氧化硫,至少需要含5吨碳酸钙的石灰石浆参加反应。求废气中二氧化硫的质量分数。_____
查看答案和解析>>
科目: 来源: 题型:
【题目】MgSO47H2O是一种重要的化工原料,某工厂以一种镁矿石(主要成分为SiO2和MgCO3,还含有少量FeCO3,其它成分忽略)为原料制备MgSO47H2O的主要流程如图:
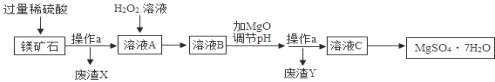
查阅资料:①SiO2既不溶于水也不溶于稀硫酸。
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
阳离子 | Mg2+ | Fe2+ | Fe3+ |
开始沉淀时的pH | 9.1 | 7.6 | 1.9 |
沉淀完全时的pH | 11.1 | 9.7 | 3.2 |
请回答下列问题:
(1)MgCO3溶于稀硫酸的化学方程式为_____。
(2)为了让镁矿石与稀硫酸充分反应,提高原料利用率,可采取的措施为_____(填字母)。
A 将镁矿石粉碎 B 降低反应温度 C 用稀硫酸多次浸泡
(3)“溶液A”中加入H2O2溶液会生成Fe2(SO4)3,该反应的化学方程式为_____。
(4)选用MgO调节pH使Fe3+转化为沉淀,而不选用NaOH的原因是_____。
(5)加氧化镁调节后溶液的pH范围是_____(用不等式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】溶液与人们的生活息息相关。
(l)下表是三种物质在不同温度时的溶解度,根据表中信息回答问题。
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | 氯化钠 | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
硝酸钾 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 | |
氢氧化钙 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 | |
①80℃的氢氧化钙饱和溶液降温至40℃,所得溶液是氢氧化钙的_____(填“饱和”或“不饱和”)溶液。
②60℃硝酸钾饱和溶液105g,若降温至20℃,析出硝酸钾晶体的质量是_____。
③20℃时,将20gNaCl加入50g水中,充分溶解,所得溶液的溶质质量分数为_____。(计算结果精确到0.1%)
④向20℃的氢氧化钙饱和溶液中加入少量生石灰,再恢复至20℃,此时溶液中钙离子数目比加入生石灰前溶液中钙离子数目_____(填“增大”“不变”或“减小”);溶液中钙离子浓度比加入生石灰前溶液中钙离子浓度_____(填“增大”“不变”或“减小”)。
⑤从硝酸钾和氯化钠(少量)的混合物中分离出硝酸钾的方法是_____(填“蒸发结晶”或“降温结晶”)。
(2)列式计算:用100g18%的氯化钠溶液配制0.9%的生理盐水,需要加水多少亳升?_____(水的密度为1.0g·mL-1)
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列反应事实写出相应的化学方程式。
(1)过氧化氢溶液和二氧化锰混合制氧气:_____。
(2)铜和硝酸银溶液反应:_____。
(3)在高温下一氧化碳还原氧化铁:_____。
(4)酒精(C2H6O)完全燃烧:_____。
(5)硫酸与氨水中和生成硫酸铵和水:_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】为验证水的组成元素及探究水在电极端所发生的变化,兴趣小组用如图1所示装置(夹持仪器省略)进行实验:
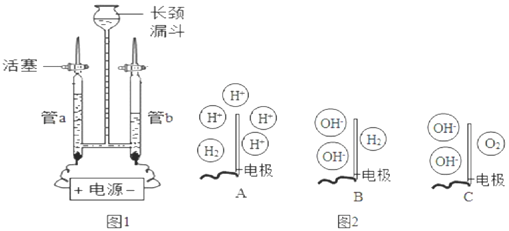
查阅资料:硫酸钠可增强水的导电性,可认为在电解水过程中不反应,硫酸钠溶液呈中性。
Ⅰ.验证水的组成元素
步骤一:向长颈漏斗中加水(含少量Na2SO4)至充满管a和管b,关闭活塞,接通电源,一段时间后关闭电源。
步骤二:检验管中气体。
(1)电解过程观察到的现象有:_____。
(2)用燃着的木条分别置于玻璃管尖嘴口,打开活塞,若观察到气体燃烧产生淡蓝色火焰,则证明气体为H2;若观察到_____,则证明气体为O2。
(3)若要确定水中氢、氧元素的原子个数比,需要测定_____。
Ⅱ.探究水在电极端所发生的变化
步骤一:向装置中重新加滴有酚酞的水(含少量Na2SO4)至充满管a和管b,保持活塞打开,接通电源,一段时间后关闭电源。
(1)实验中发现管b电极附近的溶液迅速变红,管a电极附近的溶液仍为无色,用pH试纸测定管a电极附近的溶液,pH小于7。说明管a电极附近的溶液呈_____性(选填“酸”、“碱”或“中”),管b电极附近的溶液呈碱性。
(2)图2中能表示电解时管b中水在电极端所发生变化的结果的是_____(填对应选项的字母)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com