
科目: 来源: 题型:
【题目】氢化镁(化学式为MgH2)是一种常用的焰火剂,某兴趣小组拟选用如下图装置制备氢化镁。
(查阅资料)
(1)氢化镁可用氢气与纳米级镁粉加热制得。氢化镁遇水反应生成氢氧化镁[Mg(OH)2]和氢气,并放出热量。

(2)常温下镁不与水反应,标准状况下氢气的密度为0.09g/L。
(实验步骤)
①先连接装置,再……;
②装入药品,打开分液漏斗活塞向装置中通入氢气,D处收集的气体验纯后,给C装置加热。继续通入平稳的氢气流。
③实验结束时,先停止加热,等装置冷却到室温停止通入氢气。
回答下列问题:
(1)请将步骤①中的操作补充完整____。
(2)装置A中反应的化学方程式____。A中用分液漏斗添加稀硫酸的优点是____。制得的氢化镁必须____保存。
(3)实验开始时要“先通氢气”的目的,除防止氢气遇到热的空气引起爆炸外,还有____。B装置的作用是____。
(4)实验结束同学们利用下图装置检测得到的氢化镁的纯度。取一定质量样品,如图放入Y形管一端,实验开始将Y形管倾斜,水和样品接触,共收集到氢气178ml,则样品中氢化镁的质量是____g。
(5)如果测量的结果偏大,可能的原因是____。

A.Y形管左侧的水倒入右侧排出部分气体
B.导管伸入量筒太长,未将导管拿出就读数
C.未冷却到室温就读数
D.实验前Y形管里有空气
查看答案和解析>>
科目: 来源: 题型:
【题目】钠的化合物在日常生活中应用广泛,请回答下列问题.

(1)氢氧化钠稀溶液可用于鸡舍消毒,氢氧化钠的俗名是_____(写一种).
(2)次氯酸钠(NaClO)是84消毒液的有效成分,次氯酸钠中氯元素的化合价为_____.
(3)碳酸氢钠可用于治疗胃酸过多症,碳酸氢钠与盐酸反应的化学方程式为_____.
(4)今年我市初中化学实验考查的内容是粗盐提纯中的部分操作.
①将海水进行_____可得到粗盐.在实验室若将粗盐经溶解、_____和_____等步骤,可初步提纯得到精盐.
②提纯后的食盐中还含有少量的CaCl2和MgCl2等可溶性杂质,将该食盐溶解后,依次加入过量的NaOH溶液、过量的_____(填化学式,下同)溶液,过滤,向滤液中加_____调节至pH=7,再将滤液蒸发结晶,即可得更纯的氯化钠.
③碳酸钠和盐酸反应也能生成氯化钠,工业上不用此反应制备氯化钠的原因是成本比较高或海水中富含氯化钠,_____.
(5)如图1是配制溶质质量分数为10%的氯化钠溶液的实验操作示意图:
①用图中序号表示配制溶液的正确顺序是_____.
②称量氯化钠时,天平平衡后的状态和游码标尺示数如图所示,则称取的氯化钠质量为_____g.称量质量完毕放回砝码时,发现有一个砝码缺损了一角,若其他操作步骤正确,则所配溶液中溶质的质量分数_____(填“大于”“小于”或“等于”)10%.
(6)如图2所示A、B分别表示两个化学反应,但生成物中都有氯化钠.
①A是钠与氯气反应生成氯化钠的示意图,氯化钠由离子_____(选填“原子”“分子”“离子”)构成.
②B描述了氢氧化钠溶液与盐酸反应的微观实质,该反应所属基本反应类型为复分解_____反应;图中a、b、c处应填入的化学符号依次为_____.
查看答案和解析>>
科目: 来源: 题型:
【题目】向一定质量的AgNO3和Cu(NO3)2的混合溶液中加入过量的Zn粉,溶液质量随反应时间变化的情况如图所示。下列说法不正确的是( )
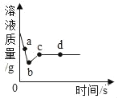
A. 取a点溶液,滴加稀盐酸,有白色沉淀出现
B. 图标上b~c段质量增加的原因是Zn和Cu(NO3)2溶液反应
C. b点时溶液中金属离子有Zn2+、Cu2+,金属单质只有Ag
D. c点和d点溶质种类不同,金属单质种类也不同
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为甲、乙两种固体物质在水中的溶解度曲线,下列说法错误的是( )

A. 在 t1℃时,50g 水可以溶解 25g 甲物质
B. 在 t1℃时,等质量甲、乙溶液中溶质质量相等
C. 在 t2℃时,N 点表示甲物质的不饱和溶液
D. 甲中混有少量的乙可以采用降温结晶法提纯甲
查看答案和解析>>
科目: 来源: 题型:
【题目】用高锰酸钾制取氧气,固体的质量变化情况如图所示,下列分析不正确的是( )
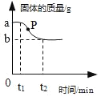
A. a 与 b 质量差是生成氧气的质量
B. P 点处固体成分是锰酸钾和二氧化锰
C. 反应前高锰酸钾的质量为![]()
D. 反应过程中,锰元素在固体中的质量保持不变
查看答案和解析>>
科目: 来源: 题型:
【题目】已知溶液的导电性与单位体积内离子的数目、离子所带电荷多少有关,单位体积内离子数目越多,导电性越强;离子所带电荷越多,导电性越强(如两个氯离子和一个硫酸根离子导电性相当)。现向含有Ca(OH)2和NaOH的混合液中通入CO2气体,下列测得溶液导电性(用“电流强度I”表示)变化与通入CO2气体体积(V)关系图象正确的是( )
A. 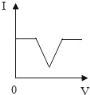 B.
B. 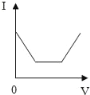
C. 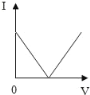 D.
D. 
查看答案和解析>>
科目: 来源: 题型:
【题目】为解决水中氧气不足的问题,通常向鱼池中撒一种微黄色的固体,这种固体的主要成分是过氧化钙(CaO2),CaO2与Na2O2都属于过氧化物,它们的化学性质非常相似。过氧化钠与水反应的化学方程式是:2Na2O2+2H2O=4NaOH+O2↑
⑴写出CaO2与H2O反应的化学方程式______________________________________;
⑵现称取20g样品加入到足量的水中,结果生成3.2g O2(样品中其它成分与水不反应)。请计算该样品中CaO2的质量分数___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)碘盐就是在食盐中加入一定量的碘酸钾(KIO3),回答下列问题.
碘酸钾的相对分子质量为_____;在碘酸钾中碘元素的质量分数是_____;_____ g 碘酸钾中含碘 25.4g。
(2)配制50g溶质的质量分数为4%的氢氧化钠溶液,需要氢氧化钠和水各多少克__________、__________ ?若要完全中和这些溶液.需要溶质的质量分数为3.65%的稀盐酸多少克_____?
查看答案和解析>>
科目: 来源: 题型:
【题目】阅读下面科普短文。(原文作者:吴秀玲,原文有删改)
随着生活水平的提高,人们正在不断改善着自己的居家环境,房屋装修越来越普遍。房屋装修会对室内空气质量产生影响,严重时会危害人体健康。为推行“健康住宅”,保障人们的身体健康,国家制定了《室内空气质量标准》,已于2003年3月1日起开始实施。
房屋装修后室内空气污染物的检测
参照国家《室内空气质量标准》GB/T18883—2002,采集60户装修后0~18个月的室内空气样品,检测甲醛、苯、氨的含量(检测前关闭门窗12小时,并打开室内所有橱柜和抽屉,以保证污染物有一个最大释放和平衡过程)。检测结果见下表。
指标 | 甲醛 | 苯 | 氨 |
GB/T18883 —2002(mg/ m3) | ≤0 .10 | ≤0 .11 | ≤0 .20 |
浓度范围(mg/m3) | 0.02-2.19 | 0.01-1.20 | 0-1.86 |
最大超标倍数 | 12.9 | 10 | 5.3 |
超标率(%) | 89 | 50 | 35 |
检测结果分析
(1)室内空气主要污染物及原因
由上表看出,装修后室内空气的首要污染物为甲醛,其次是苯和氨。在超标严重的家庭中,有的是过度装修,有的是购买了大量的新家具,有的是大量使用了人造板材、油漆、粘合剂、乳胶漆等,这些材料会持续向室内释放大量有害气体。
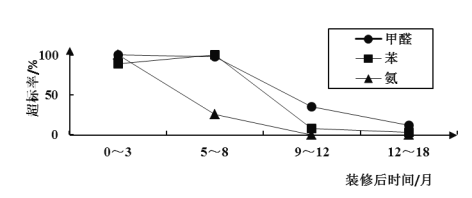
(2)室内空气污染物含量随时间的变化:0~3、5~8、9~12、12~18个月后,室内空气中甲醛、苯、氨含量的超标率随时间变化曲线如下。
(3)室内空气污染物含量的反弹现象
跟踪检测发现,同年11月份室内甲醛浓度为0.15 mg/m3 (室内没有暖气、气温15℃、湿度30%)的房屋,12月份变为0.35 mg/m3 (室内有暖气、气温21℃、湿度35%)。
依据文章内容回答下列问题。
(1)按照国家标准,室内空气中苯的含量不得超过_______mg/m3。
(2)室内空气首要污染物甲醛(HCHO)分子中C、H、O原子个数比为_______。
(3)依据超标率随时间变化的曲线,得到的结论是_______。
(4)引起室内空气污染物含量反弹现象的原因可能是_______。
(5)请你对改善室内空气质量提一条合理化建议_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列实验装置图,按要求回答下列问题:
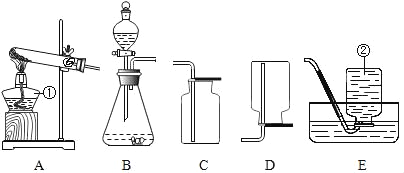
(1)写出标号仪器的名称:①______;②______。
(2)实验室可用氯酸钾和二氧化锰制取氧气,其反应的化学方程式为______,若要收集较纯净的氧气可选择的收集装置为______。
(3)实验室制取并收集二氧化碳应选择的装置为______; 装置B中用分液漏斗代替长颈漏斗的优点是
______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com