
科目: 来源: 题型:
【题目】超细碳酸钙可用于生产钙片、牙膏等产品。利用碳化法生产超细碳酸钙的主要流程示意如下:
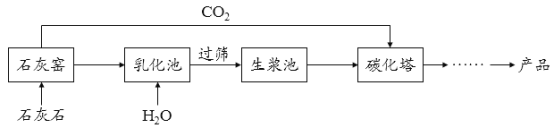
(1)石灰石主要成分的化学式为_____________________。
(2))乳化池中,生石灰与水发生反应,其化学方程式为 __________________。
(3))过筛的目的是拦截____________(填“大于”或“小于”)筛孔直径的颗粒。
(4))碳化塔中反应的化学方程式为 ____________________。
(5)生产过程中循环使用的一种物质是___________
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是硫酸铜溶液与锌粒反应前后溶液中主要离子变化示意图。
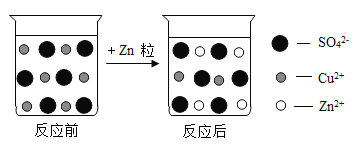
(1)锌与硫酸铜溶液发生反应过程中变化的微观粒子是 ______
(2)反应中过量的物质是_______(写化学式)。
(3) 该反应的化学方程式为________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】欲配制100 g溶质质量分数为8%的氯化钠溶液,实验操作如下:

(1)实验中正确的操作顺序为________(填序号)。
(2)上面的实验中玻璃棒的作用是____________
(3)称量氯化钠固体的质量时所选砝码的质量和游码的示数(如下图)______。

(4)若在操作①中,有部分氯化钠洒落桌面,则所得溶液溶质的质量分数会_____(填“偏大”“不变”或“偏小”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下图回答问题。

(1)实验室制取二氧化碳,选用的发生装置是______(填序号)。
(2)用装置B制氧气,其铁架台的作用是_________,其反应的化学方程式是________。
(3)用装置D收集氧气时,下列实验操作正确的是______(填序号)。
a.加热前,将集气瓶装满水,用玻璃片盖住瓶口,倒立在盛水的水槽中
b.加热后,观察到水中导管口开始有气泡时,立即收集气体
c.待集气瓶里的水排完后,在水面下用玻璃片盖住瓶口,移出水槽正放在桌面上
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D都是初中化学中常见物质,A是人类赖以生存的一种无色液体,D是一种黑色固体,具有如图所示的转化关系(反应条件、其他反应物及多余产物均略去):
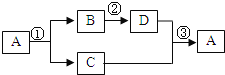
(1)写出①反应的化学方程式 ;
(2)D可能是 (填化学式);
(3)反应③的基本反应类型是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】甲、乙两种物质的溶解度曲线如下图所示,下列叙述正确的是( )
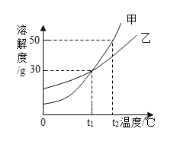
A. 甲和乙的溶解度相等且均为30g
B. 甲物质的溶解度随温度的升高而减小
C. t1℃时,乙的饱和溶液中溶质与溶剂的质量比为3:7
D. 将t2℃甲的饱和溶液降温到t1℃,有固体析出
查看答案和解析>>
科目: 来源: 题型:
【题目】19世纪初,铝是比黄金还贵的金属,主要是由于铝的化学性质很活泼,在自然界以化合物形式存在。当时采用钠与氯化铝在一定条件下发生置换反应得到铝,因生产成本高,所以铝十分珍贵。19世纪末,霍尔应用电解熔融金属化合物的方法制备金属。他在用氧化铝制备金属铝的过程中,发现氧化铝的熔点很高(2050 ℃),很难达到熔融状态,必须寻找一种能够溶解氧化铝而又能降低其熔点的材料,实验过程中发现冰晶石(Na3AlF6)能起到这种作用。霍尔在坩埚中,把氧化铝溶解在10%~15%的熔融的冰晶石里进行电解,发现有小球状银白色的铝生成,冰晶石在电解过程中不被分解,并有足够的流动性,有利于电解的进行。这种廉价炼铝方法的发现,使铝成为广泛应用的金属材料,至今仍在使用。
根据文章内容,回答下列问题:
(1)金属铝的物理性质________。
(2)冰晶石中氟元素的化合价为______。
(3)霍尔用电解法制取铝的化学方程式为_______。
(4)电解法制铝的过程中,冰晶石的作用是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化工厂用石灰石和铜屑等设计生产石青、波尔多液的工艺流程如下:
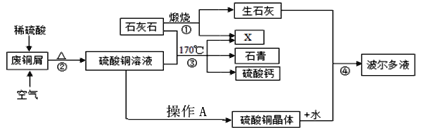
查阅资料:硫酸铜的溶解度如下表:
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
溶解度/g | 14.3 | 17.4 | 20.7 | 25.0 | 28.5 | 33.3 | 40.0 | 55.0 | 75.4 |
(产品制备)
(1)流程图中X的化学式______
(2)反应②在80℃条件下制备硫酸铜,其化学方程式为_______。操作A将CuSO4溶液进行蒸发浓缩、________、过滤、洗涤等操作即得到硫酸铜晶体。
(组成测定)

小组同学为测定石青的组成,称取了一定质量的石青样品,用如图装置进行实验。
查阅资料:
①石青的化学式可表示为aCuCO3b Cu(OH)2
②Cu(OH)2在66℃~68℃完全分解:Cu(OH)2![]() CuO+H2O; CuCO3在200℃~220℃完全分解:CuCO3
CuO+H2O; CuCO3在200℃~220℃完全分解:CuCO3![]() CuO+CO2↑
CuO+CO2↑
③ CuSO4固体为白色,CuSO45H2O固体为蓝色
实验步骤:①连接仪器,并_________, 准确称取69.2g aCuCO3bCu(OH)2放在C装置中;②打开活塞鼓入一段时间空气,称量装置D、E的质量;③关闭活塞,控制C装置中的温度为250℃对石青进行热分解,直至C装置中剩余固体质量不再变化为止;④打开活塞,_______;⑤冷却后,称量,装置D增重3.6g,装置
(3)完善上述实验步骤中的填空:①_______;④_____________。
(4)洗气瓶A中氢氧化钠溶液的作用是______;B中所装液体为____(填名称)。
(5)试确定石青的化学式______(请写出计算过程)。
(6)若缺少F装置,测得的a:b的值将________(选填“偏大”、“偏小”、“不变”)。
(脱水探究)
硫酸铜晶体受热会逐步失去结晶水。取纯净的CuSO45H2O固体2.50g,放在上图实验装置C中进行加热,测定固体质量随温度的变化情况如图所示。
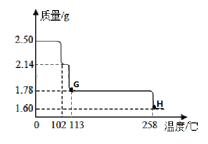
(7)G点固体的化学式是________;H点固体的颜色是_______。
(8)将CuSO45H2O固体加热到570℃分解后,得到的主要产物是黑色粉末、硫的一种氧化物和水蒸气,该反应的化学方程式为:_________。
查看答案和解析>>
科目: 来源: 题型:
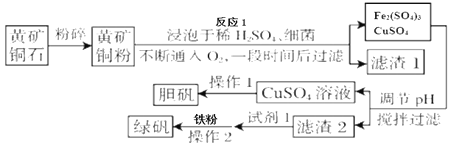
【题目】绿矾被广泛用于医药和工业领域。工业上利用黄铜矿粉(含杂质)主要成分为CuFeS2制取绿矾(FeSO4·7H2O)的流程图如下
(相关资料)
①氢氧化亚铁不稳定,在空气中容易被氧气氧化成氢氧化铁。
②三价铁离子能和金属铁反应,方程式为:Fe2(SO4)3 + Fe = 3FeSO4
③FeSO4易溶于水但不溶于乙醇。
④部分阳离子以氢氧化物形式完全沉淀时溶液的pH见下表。
沉淀物 | 开始沉淀pH | 沉淀完全pH |
Cu(OH)2 | 4.2 | 6.7 |
Fe(OH)2 | 7.6 | 9.7 |
Fe(OH)3 | 1.5 | 2.8 |
(问题解答)
(1)将黄铜矿粉粹的目的是____________。
(2)在调节pH时,为了将滤渣2充分转化为沉淀而析出,需要调节溶液pH的范围为____________。在调节pH时常用铁的氧化物来调节,不选用NaOH溶液进行调节,理由是_______。
(3)最后得到的绿矾晶体用乙醇洗涤,不用水进行洗涤的目的是_______。
(4)黄铜矿粉能够在细菌作用下,与硫酸和氧气发生反应,请写出反应1的化学方程式_______
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是实验室常用的实验装置,请回答下列问题。
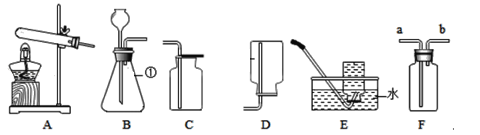
(1)写出仪器①的名称___________ 。
(2)实验室用高锰酸钾制氧气的化学方程式为____________,选择的发生装置是________(填序号),若要收集一瓶供铁丝燃烧实验用的氧气,选择_______(填序号)装置收集氧气比较方便快捷。
(3)实验室用锌粒和稀盐酸制氢气,发生反应的化学方程式为_________。若要利用F装置收集氢气,则气体应从________端通入;若要检验氢气中是否含有氯化氢气体,可选用下列物质中的__________进行检验。
A 石灰浆悬浊液 B 紫色石蕊溶液 C AgNO3溶液 D 酚酞溶液
(4)为了证明氢氧化钙溶液与稀盐酸能发生反应,氢氧化钠溶液与二氧化碳也能发生反应。如下图所示进行实验(装置气密性良好,实验前活塞和弹簧夹K处于关闭状态)。
实验一:证明氢氧化钙溶液与稀盐酸发生反应
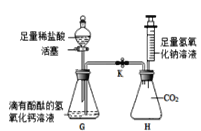
打开分液漏斗的活塞,使稀盐酸逐滴加入G锥形瓶中,观察到________的现象时,关闭活塞,证明氢氧化钙溶液与稀盐酸恰好完全反应。
实验二:证明氢氧化钠与二氧化碳反应
将注射器中的氢氧化钠溶液推入H锥形瓶中,过一段时间后,打开弹簧夹K,观察到的现象是_______,并且溶液呈红色,证明氢氧化钠溶液与二氧化碳确实发生了反应。请写出二氧化碳与氢氧化钠溶液反应的化学方程式是________。锥形瓶H中溶液最后呈红色,为了证明溶液中氢氧化钠有剩余,需进行的操作是:取H中少量溶液于试管中,向其中加足量的CaCl2溶液至不再产生白色沉淀,若溶液仍为红色,则氢氧化钠有剩余。加足量的CaCl2溶液的目的是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com