
科目: 来源: 题型:
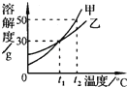
【题目】如图是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线交于点P。据图回答:

(1)P点的含义是_____。
(2)t1℃时,30g的a物质加入到50g水中不断搅拌,能形成80g溶液吗?_____(填“能”或“不能”)
(3)t2℃时a、b、c三种物质的溶解度由大到小的顺序排列的是_____(填写物质序号)
查看答案和解析>>
科目: 来源: 题型:
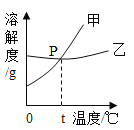
【题目】如图是甲、乙两种固体的溶解度曲线.下列说法中不正确的是
A.![]() ℃时,甲和乙的溶解度相等
℃时,甲和乙的溶解度相等
B.![]() ℃时,30g乙加到100g水中形成饱和溶液
℃时,30g乙加到100g水中形成饱和溶液
C.t2℃时,各100g饱和溶液降温至t1℃析出固体甲多于乙
D.t2℃时,75g甲的饱和溶液中加100g水得到20%的溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】如表是NaCl和KNO3在不同温度时的溶解度,其变化趋势如图所示,下列推理合理的是( )
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
A. 100g水里最多能溶解KNO331.6g
B. 表示NaCl的溶解度曲线是甲
C. 温度t的范围可能在20℃﹣30℃之间
D. 不饱和溶液变为饱和溶液,溶质的质量分数增大
查看答案和解析>>
科目: 来源: 题型:
【题目】学习酸碱盐知识后,同学们知道碳酸钠溶液与氢氧化钙溶液能发生反应,可观察到溶液变浑浊。甲组同学进行如图所示的实验,却未观察到预期现象。
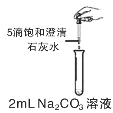
(提出问题)未观察到浑浊的原因是什么?
(猜想和假设)
①与氢氧化钙溶液的浓度有关。若使用更大浓度的氢氧化钙溶液,会迅速产生浑浊。
②与碳酸钠溶液的浓度有关。若使用更大浓度的碳酸钠溶液,会迅速产生浑浊。经讨论,同学们认为猜想①不合理,其理由是_______。
(进行实验)乙组同学针对猜想②进行实验。
实验目的 | 实验操作 | 实验现象 | |
探究猜想② | 取4支试管,向其中分别加入…… | 碳酸钠溶液浓度/% | 是否浑浊 |
10 | 不浑浊 | ||
5 | 不浑浊 | ||
1 | 浑浊 | ||
0.5 | 浑浊 | ||
(解释与结论)
(1)补全上述实验操作“……”部分:取4支试管,向其中分别加入2mL,浓度为10%,5%,1%,0.5%的碳酸钠溶液,再分别滴加_______。
(2)氢氧化钙溶液与碳酸钠溶液混合出现浑浊的化学方程式是_______。
(3)乙组实验证明:猜想②_____(填“成立”或“不成立”)。理由是_______。
(实验反思)
(4)丙组同学对乙组所做实验中未出现浑浊的原因进行探究。设计了多组实验,其中部分同学的实验过程及结果如下:
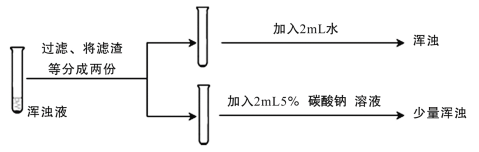
丙组同学的实验结论是_______。
(5)依据乙、丙两组的实验探究,丁组同学仍使用甲组的仪器和药品对甲组实验进行了改进,当滴入几滴某溶液后,溶液迅速变浑浊。其实验操作是_______
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上制造高纯度CaO的主要流程示意图如下:
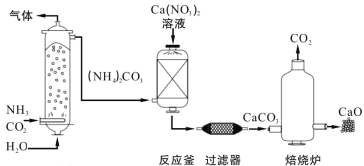
(1)NH3和(NH4)2CO3中氮元素的化合价_______(填“相同”或“不同”)。
(2)反应釜中发生的反应属于复分解反应,其化学方程式是_______。
(3)焙烧炉中,CaCO3在1000℃可分解得到高纯度CaO。理论上5tCaCO3制出CaO的质量是____t。稍冷后,取出CaO立即放入干燥器,其原因是_______(用化学方程式表示)。
(4)上述流程中可以循环使用的物质有_______
查看答案和解析>>
科目: 来源: 题型:
【题目】科学城中学一化学兴趣小组选用如图所示装置,进行CO2的制取和性质实验,请你根据所学知识,依图回答下列问题:
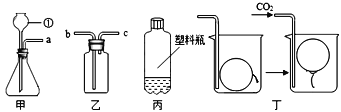
(1)写出图中仪器①的名称_______。
(2)装置甲中反应的化学方程式为_______。
(3)用装置乙排空气收集二氧化碳,验满时,燃着木条应放在_______ (填“b”或“c”)端。
(4)用图丙所示的质地较软的塑料瓶收集满CO2,再倒入一定量的紫色石蕊溶液,立即旋紧瓶盖,振荡,观察到的现象是_______。
(5)往图丁的烧杯内缓缓通入CO2,超薄材料做成的内充空气的气球会慢慢浮起,由此得出CO2具有的性质是_______。
(6)实验结束后,甲装置中仍然有固体,写出该装置中溶液里含有的微观粒子符号_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是a、b、c三种物质的溶解度曲线,a与c溶解度曲线相交于P点。据图回答:
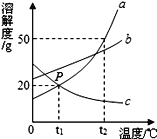
(1)P点的含义是_______。
(2)t1℃时30ga物质加入到50g水中不断搅拌,得到_____g溶液,此时a的质量分数为_______。
(3)t2℃时,a、b、c三种物质的溶解度按由小到大的顺序排列的是_______(填物质序号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】阅读下面科普短文。
SO2是一种无色、有刺激性气味、易溶于水的气体。SO2是大气主要污染物之一,是形成酸雨的主要物质。据统计, 我国大气中93.9%的SO2 来自煤炭燃烧。1998年我国正式确定了控制SO2污染的政策和措施,对SO2排放总量进行控制。
控制SO2污染的方法有:燃料在燃烧前脱硫、燃烧中脱硫及燃烧后脱硫( 即烟气脱硫)。烟气脱硫技术, 是当前应用最广、效率最高的实用脱硫技术。
烟气脱硫方法一般可分为干法和湿法两大类。湿法烟气脱硫是指应用液体吸收剂(如水或碱性溶液)洗涤含SO2的烟气,脱除烟气中的SO2。干法烟气脱硫, 是指应用干粉状或颗粒状吸收剂等来处理含SO2的烟气, 使烟气中的SO2被吸收。
实验室可以用图1装置模拟干法烟气脱硫。将煤粉碎,使其颗粒大小均匀,取3份0.5 g煤粉,其中2份分别添加0.1g 碳酸钙、0.1g碱石灰(CaO和NaOH)作为吸收剂,混合均匀后,在坩埚中进行煤燃烧实验。用SO2传感器测出3份煤燃烧过程中所排放的烟气中SO2的含量(见图2)。
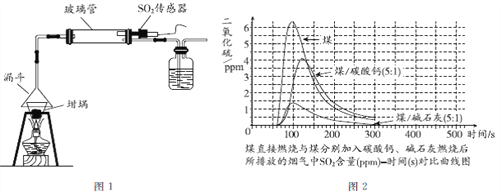
湿法烟气脱硫的优点是脱硫效率高, 稳定;缺点是能耗高,易造成二次污染, 并存在废水处理等问题。干法烟气脱硫的优点是能耗低,工艺过程简单, 无污水、无酸处理问题等。
依据文章内容,回答下列问题:
(1)大气中的SO2主要来自___________。
(2)SO2的物理性质有______(答出一条即可)。
(3)干法烟气脱硫所使用的吸收剂碱石灰属于_________(填“纯净物”或“混合物”)。
(4)实验室模拟干法烟气脱硫时,采用科学的实验研究方法是______(写出一种方法即可)。
(5)下列说法不正确的是_____(填字母序号)。
A.控制SO2的污染只能通过烟气脱硫技术解决
B.干法烟气脱硫技术与湿法烟气脱硫技术各有利弊
C.煤中加入不同吸收剂,对烟气中SO2的吸收效果不同
查看答案和解析>>
科目: 来源: 题型:
【题目】人们总是在不断寻找能源。
Ⅰ.干热岩是地层深处的热岩体。如图为利用其发电的示意图。
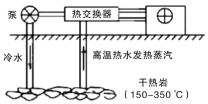
(1)将干热岩的热量传递到热交换器的物质是________。
(2)从微粒的角度分析,水变为水蒸气时,变化的是___________。

Ⅱ.中科院研制出一种将二氧化碳成功转化为汽油的方法,其流程如图所示。(如图中a、b是两种起始反应物的分子模型,c、d是最终制得的汽油中所含两种物质的分子模型)
(3)物质d中碳元素与氢元素的质量比为_________。
(4)请从原料或产品的角度,分析该成果能够解决的现实问题是__________(答出一点即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验设计不能达到实验目的的是
选项 | A | B | C | D |
实验 目的 | 验证质量守恒定律 | 验证铁丝能在 氧气中燃烧 | 验证与氧气接触是燃烧的条件之一 | 鉴别NaCl、NaOH和 稀盐酸三种溶液 |
实验 方案 |
|
|
|
|
A. AB. BC. CD. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com