
科目: 来源: 题型:
【题目】某实验小组同学对铁粉和氧化铜的混合物与足量的稀硫酸混合后,体系中各反应的先后顺序进行研究。
氧化铜与稀硫酸反应的化学方程式为________________。
(进行实验)以下实验中所用硫酸都是过量的。
实验1:将铁粉和氧化铜的混合物与60mL、10%稀硫酸混合,实验记录如下。
序号 | 铁粉/g | 氧化铜/g | 实验现象 |
1-1 | 0.56 | 1.6 | 立即出现红色固体,无气泡产生,充分反应后溶液呈蓝色 |
1-2 | 1.12 | 1.6 | 立即出现红色固体,无气泡产生,充分反应后溶液呈浅绿色 |
1-3 | 1.68 | 1.6 | 立即出现红色固体,待红色固体不再增加后产生大量气泡,充分反应后溶液呈浅绿色 |
实验2:将1.12g铁粉和1.6g氧化铜的混合物与30mL不同浓度的硫酸混合,实验记录如下。
序号 | 硫酸浓度/% | 实验现象 |
2-1 | 20 | 立即出现红色固体,无气泡产生,充分反应后溶液呈浅绿色 |
2-2 | 30 | 立即出现红色固体,瞬间产生大量气泡,充分反应后溶液呈浅蓝色 |
2-3 | 50 | 立即出现红色固体,瞬间产生大量气泡,反应过程中生成红色固体的同时持续产生细小气泡,充分反应后溶液呈浅蓝色 |
(解释与结论)
(1)浅绿色溶液中一定含有的溶质是H2SO4、____。
(2)实验中出现红色固体反应的化学方程式为_________;
(3)依据实验1推测,在稀硫酸浓度为10%,且硫酸足量的条件下,铁粉、氧化铜与稀硫酸反应的先后顺序为________。
(4)对比分析实验1-2与1-3,解释实验1-2没有产生气泡的原因______。
(5)在实验1-3中,产生氢气的质量最多为____ g。
6)根据实验2判断,下列说法不正确的是____(填字母序号)。
A 硫酸浓度为20%,CuO先于Fe与硫酸反应
B 硫酸浓度为40%,Fe将先于CuO与硫酸反应
C 硫酸浓度为50%,Fe与CuSO4反应的同时也与硫酸反应
查看答案和解析>>
科目: 来源: 题型:
【题目】化石燃料燃烧可产生SO2,最终导致降雨的酸性增强,下图是形成酸雨的一条途径,也是工业上生产硫酸的一种方法:
![]()
(1)我们把pH____5.6(填“>”“<”或“=”)的降雨称为酸雨。
(2)为减少酸雨危害,下列措施合理的有____。
A 减少汽车尾气排放 B 禁止使用化石燃料
C 将燃煤锅炉烟囱加高 D 开发风能、太阳能等新能源
(3)用氢氧化钠溶液与三氧化硫反应,该反应的化学方程式为__________。
(4)某硫酸厂化验室用10%的氢氧化钠溶液测定某产品中硫酸的质量,共消耗氢氧化钠溶液80g,得到中性溶液,求该产品中硫酸的质量______。(根据化学方程式计算,在答题纸上写出计算过程)
查看答案和解析>>
科目: 来源: 题型:
【题目】图中A~I表示初中化学几种常见的物质,且分别是由H、C、O、S、Ca、Mg、Fe、Cu中的一种或几种元素组成的。其中A、C、D、F、G、H都由两种元素组成,E是三种元素组成,且A、C是黑色固体,D、F是白色固体,F为常见食品干燥剂;I、B是单质;A、D的相对分子质量之比为2:1;图中“一”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;部分反应物、生成物或反应条件已略去。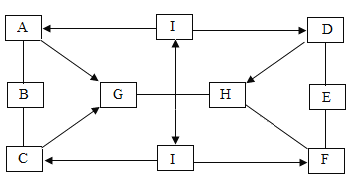
(1)写出化学式:F______。
(2)写出D与E反应的化学方程式:_______________。
(3)写出I生成A反应的化学方程式:____________________。
(4)写出C生成G反应的化学方程式:__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】海洋中蕴藏了巨量的能源和资源。
(1)我国南海海底埋藏着丰富的可燃冰。可燃冰外观像冰,主要含有甲烷水合物(由甲烷分子和水分子组成),还含少量二氧化碳等物质。
①甲烷可用作燃料,其充分燃烧的化学方程式为________。
②化学家用甲烷等为原料制成了金刚石薄膜,该变化属于____(填“物理”或“化学”)变化。
③常温常压时,由甲烷和另两种气体组成的混合物中,碳元素的质量分数为75%,则另两种气体可能是____。
A H2和CO2 B H2和C3H8 C C3H8和C3H6 D CO和C3H8
(2)研究从海洋中得到的物质a、b、c的溶解性。40℃时,取等质量a、b、c三种物质的饱和溶液于三个烧杯中(状态1),将温度降到30℃(状态2),固体析出情况如图1所示;图2为a、b、c三种物质的溶解度曲线。

仔细读图1和图2,回答下列问题。
①10℃时,a、b、c三种物质的溶解度由大到小的顺序是________。
②烧杯甲里是____物质的溶液(选填a、b、c)。
③30℃时,烧杯____里溶液中水的质量最少(选填甲、乙、丙)。
④下列说法正确的是____。
A 状态1的三个烧杯中溶剂质量大小关系为乙>甲>丙
B 状态1的三个烧杯中溶质质量分数大小关系为丙>甲>乙
C 状态2的三个烧杯中溶液质量大小关系为乙>甲>丙
D 状态2的三个烧杯中溶质质量分数大小关系为甲>丙>乙
查看答案和解析>>
科目: 来源: 题型:
【题目】锰及其化合物的价、类关系图如下
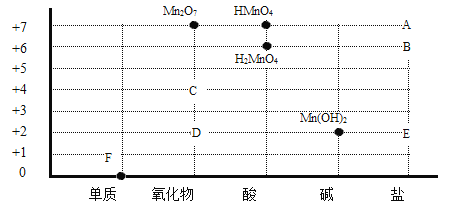
(1)金属锰是由____构成的(选填“分子”、“原子”或“离子”),是关系图中___点表示的物质。
(2)写出点D表示的物质的化学式____。
(3)A可用于实验室制氧气,同时生成B、C,写出该反应的化学方程式________。
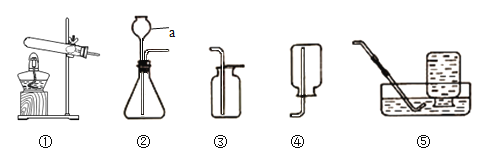
上图中标号为a的仪器名称为____。用A制取氧气,从上图选择,以下装置组合正确的是____。
A ①③ B ②③ C ②④ D ①⑤
(4)锰钢是铁、锰、碳的合金,可用来制造钢轨。钢轨的制造与应用主要体现了锰钢具有的性质有____。
A 延展性 B 导电性 C 硬度大 D 有光泽
(5)锰与盐酸反应,生成E与氢气,写出该反应的化学方程式________。
(6)有铁片、锰片(银白色),FeSO4溶液、MnSO4溶液(浅红色)四种试剂,请从其中选择合适的试剂实验,验证锰的金属活动性比铁强。
选择的试剂 | 实验操作与现象 | 得出结论 |
______ | ______ | 锰的金属活动性比铁强 |
查看答案和解析>>
科目: 来源: 题型:
【题目】化学是以实验为基础的学科,根据下列实验回答问题。
实验一 | 实验二 | 实验三 |
|
|
|
(1)实验一:待红磷熄灭冷却后,打开弹簧夹,观察到集气瓶内水面上升约______。该实验现象说明氮气具有的性质是不可燃、不助燃以及____。
(2)实验二:三天后,观察到序号为____的试管中的铁钉明显生锈。对照实验②和③,可知铁锈蚀与____有关。
(3)实验三:从长颈漏斗注入过氧化氢溶液,乙中发生反应的化学方程式为______。白磷的着火点为40 ℃。甲、丙中不同的现象是____。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定的条件下,A和B能发生化学反应生成C和D ,其微观示意图如下所示:
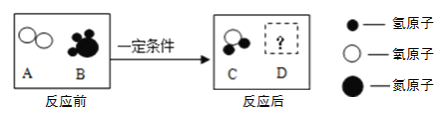
下列说法错误的是
A. B的化学式为NH3
B. 反应前的物质为混合物
C. 若该反应为置换反应,则生成的C和D的质量比为27:14
D. 若D为氧化物,反应掉的A和B的分子个数比为5:4,D的化学式为NO2
查看答案和解析>>
科目: 来源: 题型:
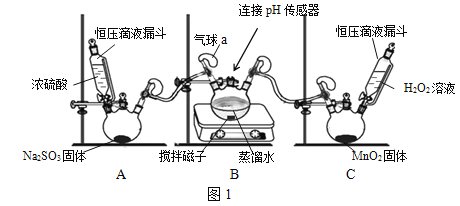
【题目】我国长江以南部分地区是世界三大酸雨区之一。某化学兴趣小组围绕酸雨的形成及燃煤电厂脱硫处理等问题进行探究。
I 模拟酸雨的形成
(查阅资料)
SO2转化为H2SO4的一条路径为:![]()
(操作步骤)
①组装仪器,检查装置气密性,装入药品。
②打开装置A中漏斗的活塞,启动装置B中的搅拌器,记录数据并绘图。
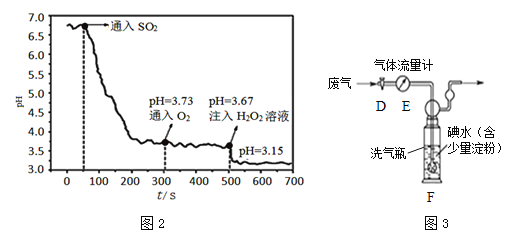
③待pH值稳定在3.73左右,打开装置C中漏斗的活塞。
④待pH值稳定在3.67左右,用注射器向气球a中注入H2O2溶液。
(问题讨论)
(1)装置A中发生的反应为Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O,其中Na2SO3中硫元素的化合价为______。装置C中发生反应的化学方程式为______。图1装置中安装气球的主要目的是______。
(2)向H2SO3中通入O2,H2SO3被氧化成酸性更强的H2SO4,但图2中pH变化不明显,这既与O2的氧化能力有关,又与氧气______的性质有关。注入H2O2溶液后,pH值明显降低,说明H2O2的氧化性比O2______(填“强”或“弱”)。
II 脱硫与SO2含量测定
(3)在燃煤中添加石灰石,SO2与石灰石、O2反应,生成硫酸钙和一种对环境无污染的气体,反应的化学方程式为______。下列措施能提高脱硫效率的是______。
A 无限延长脱硫时间 B 适当增加石灰石的用量
C 把工厂烟囱造得尽可能高 D 将石灰石和原煤粉碎并混合均匀
(4)已知燃煤电厂SO2排放标准为35mg/m3。小组同学设计图3装置进行实验:打开活塞D,将某燃煤电厂废气经气体流量计通入装置F(发生的反应为SO2+I2+2H2O===2HI+H2SO4),当碘水由蓝色褪为无色时,关闭活塞D,读出废气累计流量为3m3,若碘水中碘(I2)的质量为0.6g,计算该废气中SO2含量为______mg/m3(保留到小数点后一位),该厂废气______(填“符合”或“不符合”)排放标准。若装置F中蓝色消失后,没有及时关闭活塞D,测得的SO2含量将______(填“偏高”、“偏低”或“无影响”)。
III 知识拓展
自然界中的臭氧(O3)和H2O2能氧化H2SO3,大气污染物中含Fe、Cu、Mn、V的化合物能加快酸雨形成,一天内可在高空扩散700 多公里,所以酸雨不仅是区域性的危害,也是周边地区甚至跨国境的危害。
(5)由资料可知,大气中Fe、Cu、Mn、V的化合物可能充当了______的角色。
查看答案和解析>>
科目: 来源: 题型:
【题目】碳酸锰(MnCO3)是一种高性能磁性材料。以软锰矿粉(主要含MnO2,还含有少量的Fe2O3、Al2O3等杂质)为原料制取MnCO3的流程如下:
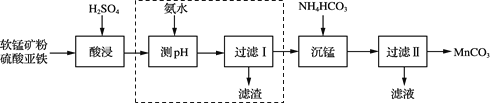
已知“沉锰”反应为MnSO4+2NH4HCO3===(NH4)2SO4+MnCO3↓+H2O+CO2↑
(1)“酸浸”时发生的主要反应为2FeSO4+MnO2+2H2SO4===X+MnSO4 +2H2O,X的化学式为______;“酸浸”时还发生的反应有______(任写一个化学方程式)。
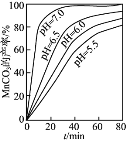
(2)流程中虚线内工序的主要目的是______。“沉锰”工序中,如图为MnCO3的产率与溶液pH、反应时间t的关系,由图可知应控制溶液的pH 为______。
(3)“过滤Ⅱ”后续的操作为洗涤、干燥,证明MnCO3固体已经洗涤干净的操作是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)用适当的化学符号表示。
①用于炼铁的气体______; ②人体胃液中含有的酸______;
③用于建筑材料的碱______; ④海水中含量最多的元素______。
(2)“中国智慧”“中国制造”越来越强。
①国产航母甲板采用“超级钢”,能承受舰载机起降时产生的强烈冲击和摩擦、飞机尾流的高温烧蚀、潮湿盐雾的海洋大气环境侵蚀。由此推测“超级钢”应具有的性质为熔点高、______、______。
②我国的高铁技术世界领先。其信息传输系统的芯片中含高纯度硅,将二氧化硅转化为硅的过程是______变化(填“物理”或“化学”);高铁钢轨采用铝和氧化铁在高温下发生置换反应实现无缝焊接,反应的化学方程式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com