
科目: 来源: 题型:
【题目】氯化钡是一种可溶性重金属盐,广泛应用于化工领域。工业上以重晶石(主要成分BaSO4,杂质为Fe2O3)为原料,通过下列流程生成氯化钡晶体(BaCl2·xH2O)并进行组成测定。
已知:①BaSO4+4C![]() 4CO↑+BaS
4CO↑+BaS
②CaO、BaO都能与水反应生成碱
(1)焙烧时,焦炭与杂质Fe2O3也会发生反应,反应方程式为_____;实际生产中必须加入过量焦炭,其目的是使重晶石充分反应,提高产率和_____。
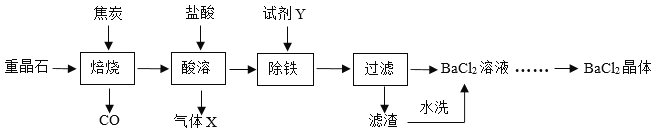
(2)焙烧时,温度和时间对硫酸钡转化率的影响如下图,则最佳温度约为_____℃,时间约为_____min。
(3)酸溶时,硫化钡(BaS)与盐酸发生复分解反应产生硫化氢气体(H2S),该反应方程式为_____;气体X成分除H2S和少量挥发出的HCl、水蒸气外,还含有_____。
(4)除铁反应中试剂Y可以是_____(填字母)。
a.NaOH溶液 b.氨水 c.生石灰 d.BaO固体
证明铁已除尽的方法是:取上层清液于试管中,滴入_____溶液,若无明显现象,则已除尽。
(5)滤渣水洗的目的是提高晶体产率和_____。
(6)测定晶体(BaCl2·xH2O)的组成:
Ⅰ.称取24.4gBaCl2晶体,置于小烧杯中,加入适量蒸馏水,使其全部溶解。
Ⅱ.再边搅拌边滴加稀硫酸到沉淀完全,静置;
Ⅲ.过滤并洗涤沉淀;
Ⅳ.将盛有沉淀的滤纸包烘干并中温灼烧后,称得BaSO4沉淀质量为23.3g。
①通过计算,确定x的值。_____(写出计算过程)
②操作Ⅳ中,如果空气不充足和温度过高,可能会有部分沉淀被滤纸中的碳还原为BaS,这使x的测定结果_____(填“偏低”、“偏高”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】据统计,我国每年报废的手机超过1亿部,若不进行有效回收利用,会造成巨大的浪费和污染。同学们对废旧手机中的金属回收产生兴趣。
(提出问题)
从废旧手机中可以回收到哪些有价值的金属?如何回收?

(查阅资料)
Ⅰ.手机电路板中的金属及其价格如下表所示:
种类 | Fe | Cu | Al | Ni | Au | Ag | Pd(钯) |
市场价格/($/t) | 365 | 7175.5 | 1710.5 | 14235 | 4.7×107 | 7.6×105 | 2.7×107 |
矿石中含量 | 72.4 | 0.87 | 29.1 | 1.02 | 4 | 120 | 0.4 |
手机电路板中含量 | 5 | 13 | 1 | 0.1 | 350 | 1380 | 210 |
说明:Fe、Cu、Al、Ni的含量用质量分数(%)表示,Au、Ag、Pd的含量的单位为“g/t”。
Ⅱ.Ni的金属活动性位于氢前;Pd的金属活动性位于氢后;NiCl2溶液为绿色。
(实验方案)

第一步:选择值得回收的金属。
依据资料Ⅰ中的数据,废旧手机中有回收价值的金属有Au、Ag、Cu、Pd,
(1)原因是:①它们的市场价格较高;②_____。
第二步:设计实验分离、回收部分金属。
序号 | 实验步骤 | 实验现象 |
Ⅰ | 取一废旧手机电路板,用电吹风机靠近电路焊接点的焊锡吹热风,一段时间后,用镊子将金属电路从塑料板中拽出 | 焊锡熔化 |
Ⅱ | 将金属电路放入烧杯中,加入过量10%的稀盐酸浸泡 | …… |
Ⅲ | 取Ⅱ中未溶解的金属电路,用蒸馏水洗净后,放入如上图所示装置中,进行实验。 | 溶液逐渐变成蓝色,仍有微量金属固体未溶解 |
Ⅳ | 过滤Ⅲ中烧杯中的物质,洗涤滤纸上的物质 | 滤纸上仍有微量金属固体 |
(问题讨论)
(2)由步骤I中的现象,可推知的焊锡的物理性质是_____(填字母)。
a.熔点低 b.硬度大 c.抗腐蚀性强
(3)步骤Ⅱ中实验室用溶质质量分数为37%、密度是1.18gmL-1的浓盐酸配制10%的盐酸185g,需要浓盐酸_____ml;配制该稀盐酸应选择的量筒量程(水的密度为1g/cm3)为_____(填字母)。
a.10ml b.50ml c.100ml d.200ml
(4)步骤Ⅱ所得溶液中,至少含有_____(填数字)种溶质,该步骤中对应的实验现象是_____。
(5)请写出步骤Ⅲ中,溶液变成蓝色的化学方程式_____。
(6)步骤Ⅳ中过滤操作用到的玻璃仪器有玻璃棒、_____和_____,其中玻璃棒的作用是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】CO2是一种宝贵的碳氧资源。某兴趣小组对CO2的研究如下:
已知:常温下,CO2难溶于饱和NaHCO3溶液。
Ⅰ.CO2的制备和收集:
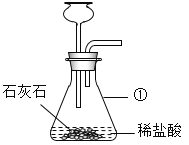
(1)写出图中标号仪器的名称:①_____。
(2)写出用石灰石和稀盐酸制取CO2的化学方程式_____。图中装置有一处明显的错误是_____。
(3)常温下,下列收集CO2的方法中可行的是_____(填字母)。
a.向上排空气法 b.向下排空气法 c.排饱和NaHCO3溶液法
Ⅱ.CO2的利用:
全球能源生产正向“氢能经济”转型,以CO2和可再生生物资源(如纤维素等)为原料生产氢气已成为能源研究的重点。下图是某新型能源转换与利用模式示意图:

(4)该模式中涉及的能源转化依次为:太阳能→生物质能→氢能→_____。
(5)该系统中循环使用的物质是_____。
(6)与电解水相比,该模式制取氢气的主要优点是_____。
Ⅲ.探究CO2与NaOH的反应:
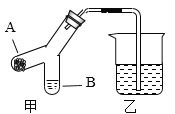
(7)如图装置,气密性良好。在A处放置适量干冰,B处装入适量的浓NaOH溶液,烧杯中加入足量的稀盐酸。实验过程中,观察到乙中导管口有气泡冒出,原因是_____。
(8)一段时间后,观察到的现象是:乙中_____,B中_____,说明CO2与NaOH发生反应,写出CO2与NaOH反应方程式为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】阅读下面文字,回答相关问题。
油炸薯片受到营养专家的反对,因为其经油炸后含有大量的反式脂肪酸(C18H34O2)。反式脂肪酸进入人体后,导致必需脂肪酸缺乏;抑制婴幼儿的生长发育等。下图为某品牌薯片的包装和营养成分表:

(1)厂商常将N2充入包装袋内做保护气,是因为N2的化学性质_____(填“活泼”或“稳定”);该包装采用铝塑袋包装,它是在双层塑料薄膜中间夹一层铝膜,该包装袋是_____(填字母)。
a.无机材料 b.合成纤维 c.复合材料
(2)表中的脂肪、蛋白质和_____能够为人体提供能量。营养成分表中未标示,但_____和水也是人体必需的基本营养物质。食用下列扬州特产主要与蛋白质摄入有关的是_____(填字母)。
a.仪征紫菜 b.高邮咸鸭蛋 c.宝应藕粉
(3)表中的钠元素_____(填“属于”或“不属于”)人体必需的微量元素;儿童缺少_____(填元素符号),也会导致生长发育迟缓,智力低下。
(4)反式脂肪酸(C18H34O2)_____(填“是”或“不是”)有机高分子,其中碳元素的质量分数为_____(精确到0.1%)。
查看答案和解析>>
科目: 来源: 题型:
【题目】水是生命之源,人类是自然之子,水则如同孕育生命的母亲。2019年5月3日至6日,首届大运河文化旅游博览会在扬州成功举办。
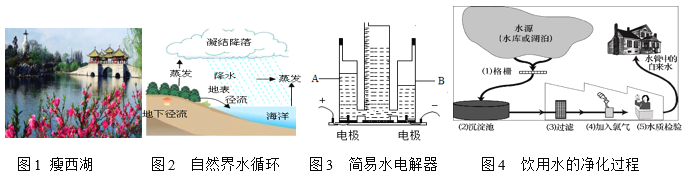
(1)图1:“诗画瘦西湖,人文古扬州”。清澈的瘦西湖水是_____(填“混合物”或“纯净物”)。经检测,湖水为轻度富营养化,是由_____(填元素符号)元素引起的。
(2)图2:在水蒸发的过程中,下列说法正确的是_____(填字母)。
a.水分子大小改变 b.水分子之间间隔不变 c.氢、氧原子不变
地下水中的颗粒和细菌等杂质比湖水、河水等地表水中的少,请写出一个原因_____。
(3)图3:通电一段时间后,若A管中收集2L的气体,则B管内收集的气体体积约为_____L。电解时,加入少量NaOH能增强导电性,是因为其溶于水能产生自由移动的_____和_____(填离子符号)。电解水的化学方程式为_____。
(4)图4:水源中含有较多的杂质。含有较多可溶性钙、镁化合物的水叫做_____(填“软水”或“硬水”),区分硬水和软水常用_____(填物质名称)。图中氯气的作用是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用如下装置进行实验,下列有关实验和结论正确的是
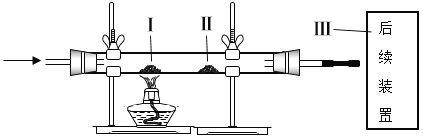
A. 缓慢通入N2,再加热Ⅰ处的碳酸氢铵,可观察到Ⅱ处红色石蕊试纸变成蓝色
B. 先缓慢通入CO2,再加热Ⅰ处炭粉,一定观察到Ⅱ处氧化铁粉末由红色变成黑色
C. 先缓慢通入空气,再加热Ⅰ处红磷,根据Ⅰ处燃烧而Ⅱ处红磷不燃烧说明可燃物燃烧一般需要与氧气接触
D. 先缓慢通入空气,再加热Ⅰ处8.00 g黄铁矿样品(主要成分为FeS2,杂质高温下不反应,反应方程式为:4FeS2 +11O2![]() 2Fe2O3+8SO2),测得Ⅲ处碱石灰增重6.40 g,则ω(FeS2)= 75%
2Fe2O3+8SO2),测得Ⅲ处碱石灰增重6.40 g,则ω(FeS2)= 75%
查看答案和解析>>
科目: 来源: 题型:
【题目】KNO3与NaCl的溶解度曲线如图所示。下列说法正确的是
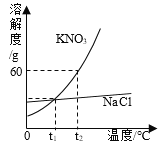
A. t1℃时,等质量的KNO3和NaCl饱和溶液中溶质质量一定相等
B. t2℃时,100 g KNO3的饱和溶液中含KNO3 60 g
C. KNO3溶液中混有少量NaCl,可采用蒸发结晶的方法提纯KNO3
D. 其它条件不变,升高温度可使KNO3的饱和溶液变成不饱和溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】镁在国产大飞机C-919”的制造中大显身手,小亮在实验室模拟“海水制镁”的原理来富集镁,他将25g氯化钠和氯化镁的固体混合物全部溶解于盛有70g水的烧杯中,然后向其中加入63.6g氢氧化钠溶液至恰好完全反应(图像如下),过滤,称量滤液质量为147g,求:
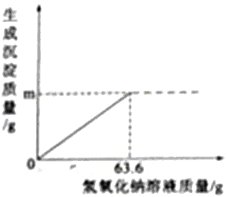
(1)图像中m=_____g。
(2)滤液中溶质的质量分数是____________?
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A、B、C、D是初中化学常见的四种不同类别的物质,相邻两种物质可以发生化学反应,分别生成甲、乙、丙、丁四种物质(部分生成物已略去),它们相互之间的关系如图所示。其中B是配制农药波尔多液的成分之一,其水溶液呈蓝色;C为应用最广泛的金属:丙为氯化物。
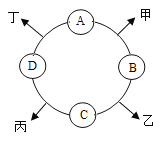
(1)B的化学式是_____,A所属的物质类别是_____。
(2)A与D反应的化学方程式为_____。
(3)B的溶液与C反应,溶液质量_____(填“增大”、“减小”或“不变”)
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列装置图,回答问题:
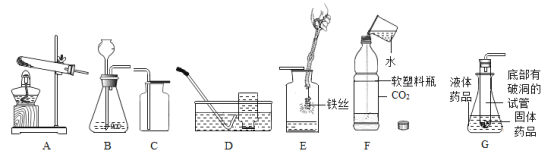
(1)实验室要制取一瓶氧气做E中实验,选择的装置组合最好是_____,反应的化学方程式为_____。
(2)图G是某同学利用报废试管设计的实验室制取二氧化碳的发生装置,该设计除了废物利用的优点外,请另写一个优点:_____,反应的化学方程式为_____。
(3)如图F向装满CO2的软塑料瓶注入约1/3体积的水,立即旋紧瓶盖,振荡,观察到的现象是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com