
科目: 来源: 题型:
【题目】某食品包装袋中“双吸剂”标签如表所示:
品名:双吸剂
成分:铁粉、生石灰
化学兴趣B组的同学们对这包久置的“双吸剂”样品很感兴趣,设计了下列实验进行探究。
(提出问题)久置的“双吸剂”固体的成分是什么?
(查阅资料)常温下,铁能与氯化铁溶液反应生成氯化亚铁。
(作出猜想)久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2、CaCO3
(定性研究)
(1)小明取少量样品放入试管中,加入一定量的稀盐酸,观察到试管中的固体质量逐渐减少,生成了一种能使澄清石灰水变浑浊的气体,得到了浅绿色的溶液。小明初步判断:样品中一定含有_____(填化学式),一定不含Fe2O3
(实验质疑)
(2)兴趣小组的同学们讨论后认为上述实验并不能得出一定不含Fe2O3的结论,理由是:_____、_____(用化学方程式表示)。为了进一步确定这包久置的“双吸剂”固体的成分,同学们继续进行如下定量实验。
(定量研究)
(3)取3.0g样品研碎,并用磁铁充分吸收后,得到剩余固体2.6g,按照下列流程进行实验:
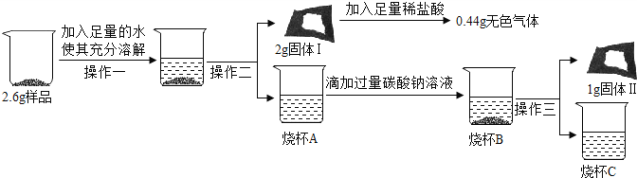
①操作二和操作三的名称为_____。
②固体I的成分是_____(填化学式)。
③写出生成固体Ⅱ的化学方程式:_____。
(得出结论)
(4)根据定性、定量研究中的现象和数据分析判断,这包久置的“双吸剂”固体的成分为_____(填化学式)。
(实验反思)
(5)结合上述的实验,下列说法不正确的是_____(不定项选择)。
A 对物质成分的研究有时需要定性和定量相结合
B 在原样品中加入足量的稀盐酸后有4个反应发生
C (定量研究)烧杯C中的溶质为NaOH和Na2CO3
D (定量研究)3.0g样品中氢氧化钙的质量小于0.10g
查看答案和解析>>
科目: 来源: 题型:
【题目】化学兴趣A组的同学们利用废硫酸液制备K2SO4,设计的流程如下图所示:
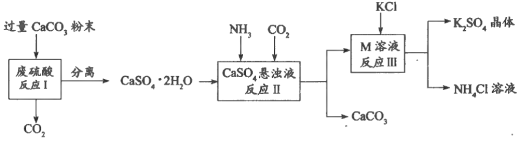
(1)写出反应Ⅰ的化学方程式:___________________________________________。
(2)反应Ⅱ生成了一种可用作氮肥的物质M,M的化学式为_________________。
(3)上述流程中可循环使用的物质有CO2和_____________________(填化学式)。
(4)反应Ⅲ中相关物质在25℃时的溶解度如下表。
物质 |
|
|
|
|
溶解度/g | 34.0 | 11.1 | 37.2 | 19.5 |
反应Ⅲ在常温下(25℃)能实现的原因是___________________________________。
(5)不用水而用饱和K2SO4溶液洗涤反应Ⅲ所得晶体的目的是_____________;为了检验此晶体是否洗涤干净,常取最后一次洗涤液于试管中,先加入过量的_____________(选填字母),振荡、静置, 再向上层清液中滴加_____________(选填字母),观察现象即可判断该晶体是否洗涤干净。
A AgNO3溶液 B BaCl2溶液 C Ba(NO3)2溶液
D Ba(OH)2溶液 E NaOH溶液 F KOH溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】写出下列反应的化学方程式,并按要求填空。
(1)硫磺在纯氧中燃烧:___________________,燃烧时火焰的颜色为________。
(2)硫化氢气体在空气燃烧生成二氧化硫等物质:_________________________。
(3)在空气中尘埃等的作用下,二氧化硫被氧化成三氧化硫:__________________,尘埃在反应中所起的作用为_________________________。
(4)稀硫酸和氢氧化钾溶液反应:_____________________________,该反应的基本反应类型是______________。
(5)少量SO2通入某碱溶液中发生反应生成了(NH4)2SO3:______________。
(6)反应前后有元素化合价发生变化的反应称为氧化还原反应。上述5个反应中有____个反应属于氧化还原反应。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室常用分解高锰酸钾来制取氧气。
(1)写出高锰酸钾制氧气的化学方程式:_________________________________。
(2)本次实验要用排水法收集2瓶200 mL的氧气(其中一瓶存留少量水)和向上排空气法收集1瓶100 mL的氧气。
①氧气能用排水法收集的理由是_________________________。
②若实验时氧气的密度按1.35g·L–1计,则取用________(选填字母)的高锰酸钾比较适宜(设每药匙约取用2g高锰酸钾)。
A. 2药匙 B. 4药匙 C. 6药匙 D. 8药匙
(3)检查装置的气密性为良好后,向大试管中加入高锰酸钾粉末,使其______________,并________,然后按课本第35页图2–8所示组装实验装置。组装过程中要根据____________的高度,将气体发生装置固定在铁架台的合适位置上。
(4)先_________,再加热试管(要先预热),当_____________时,开始用排水法收集气体。
(5)用向上排空气法收集氧气时,当观察到____________时,移出导管,熄灭酒精灯。
(6)用收集到的3瓶氧气分别做细铁丝、木炭和小蜡烛的燃烧实验。
查看答案和解析>>
科目: 来源: 题型:
【题目】用铁、氧化铜、稀硫酸、氢氧化钠溶液和硫酸铜溶液五种物质构成了如下图所示的关系网络(图中的“——”表示相连的两种物质常温下能发生反应)。下列说法不正确的是
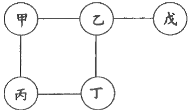
A. 甲可能为氢氧化钠溶液
B. 乙可以使紫色石蕊溶液变红
C. 丙和丁的反应一定是置换反应
D. 戊一定是氧化铜
查看答案和解析>>
科目: 来源: 题型:
【题目】KCl的溶解度曲线如图所示。在下表对应的温度下,向4只盛有100 g水的烧杯中,分别加入40 g KCl固体,充分溶解。
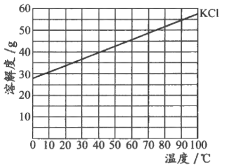
烧杯序号 | ① | ② | ③ | ④ |
温度(℃) | 20 | 30 | 50 | 60 |
下列关于①~④所得溶液的说法不正确的是
A. 溶质质量:①<②
B. 溶液质量:②<③
C. 溶质质量分数:③<④
D. ④中溶质与溶剂的质量比为2: 5
查看答案和解析>>
科目: 来源: 题型:
【题目】以甲为原料合成化工产品丁的微观过程如图所示,下列说法正确的是( )

A. 转化①属于分解反应
B. 转化②属于化合反应
C. 转化①中乙和丙的质量比为7:1
D. 转化②中乙和丙的分子数之比为1:2
查看答案和解析>>
科目: 来源: 题型:
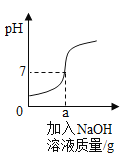
【题目】用溶质质量分数为5%的NaOH溶液中和73g的稀盐酸,反应过程中溶液的酸碱度变化如图所示。请计算
(1)用质量分数为10%的氢氧化钠溶液配制5%的氢氧化钠溶液100g,需要水_____克。
(2)当a为80g时,所得溶液中溶质的质量分数是多少____________(结果精确到0.1%)?
查看答案和解析>>
科目: 来源: 题型:
【题目】同学们在学习碱的化学性质时,进行了如图所示的实验.

(1)分别写出甲、乙、丙实验中发生反应的化学方程式:
甲_____;乙_____;丙_____.
从微观的角度看,丙反应的实质是_____.
(2)乙实验中滴加氢氧化钠溶液后,可观察到的现象是_____.
(3)丙实验中观察到试管内有白色沉淀产生.
(4)实验结束后,同学们将甲、乙、丙三个实验的废液倒入同一个干净的废液缸中,最终看到废液浑浊并呈红色,产生疑问.
[提出问题]废液中含有哪些物质?
[交流讨论]①一定含有的物质:碳酸钙、指示剂、水和_____(写物质名称).
②还含有能使废液呈碱性的物质.
能使废液呈碱性的物质是什么?同学们有如下猜想.
小云认为:只有碳酸钠
小红认为:只有氢氧化钙
小林认为:是氢氧化钠和碳酸钠
你认为还可能是_____(写一种猜想).
[实验设计]小方想用氯化钙溶液来验证小云、小红、小林的猜想.查阅资料获悉氯化钙溶液呈中性,并设计如下实验.请你将小方的实验设计补充完整.
实验内容 | 预计现象 | 预计结论 |
取少量废液缸中上层清液 于试管中,加入过量 氯化钙溶液,静置. | ①有白色沉淀,溶液呈红色. | _____的猜想正确. |
②_____. | _____的猜想正确. | |
③_____. | _____的猜想正确. |
[反思拓展]在分析化学反应后所得物质的成分时,除了考虑生成物外还需考虑_____.
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是水厂利用水库中的水生产自来水的主要流程:
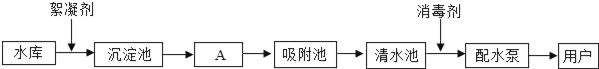
请回答下列问题:(1)水库中的水属于_____(填“纯净物”或“混合物”).
(2)①A池中通过_____(填操作名称)除去水中的固体杂质.②国家规定的自来水PH范围为6.5﹣8.5.为了测定家用自来水是否达到这一标准,可用_____来进行检测.
(3)自来水中通常都含有Cl﹣,可以在水样中滴加少量稀硝酸和_____检验,若出现_____现象,说明水中含有Cl﹣.水中的Ca2+、Mg2+受热后转化为沉淀,即通常所说的水垢,水垢的主要成分为_____.
(4)把自来水进一步净化为蒸馏水的实验方法是_____,实验室制取蒸馏水的蒸馏烧瓶里,通常要加入几粒沸石或碎瓷片,作用是_____.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com