
科目: 来源: 题型:
【题目】探究气体的制取:
同学们总结归纳了气体的实验室制法,并利用下列装置进行练习和拓展。
(一)知识归纳总结
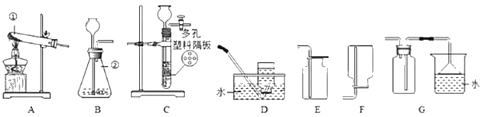
(实验仪器)写出装置图中标号仪器的名称:①_____;②_____。
(反应原理)
①用氯酸钾和二氧化锰混合制氧气的化学方程式为_____。
②用锌和稀硫酸制取氢气的化学方程式为_____。
(气体制备)
①用不同的药品制取气体,发生装置可能不同。确定发生装置时应考虑的因素是_____。
A 反应是否需要加热 B 反应物的密度
C 所用药品的状态 D 反应物的纯度
②用锌粒与稀硫酸制取氢气,装置C较装置B的优点是_____。
③在不改变装置特点的情况下,装置B和装置C中的长颈漏斗_____(填编号字母)改成分液漏斗。
A 都能 B 都不能 C 装置B能,装置C不能 D 装置B不能,装置C能
(二)知识拓展
加热氯化铵和熟石灰的固体混合物可得氨气,实验室用装置A和F制备和收集氨气,该反应的化学方程式为_____,下列关于氨气的推测中正确的有_____。
A 氨气可用装置D收集 b 氨气容易被水吸收
C 氨气的密度大于空气 d 氨气会对空气造成污染
查看答案和解析>>
科目: 来源: 题型:
【题目】探究铁生锈的条件
取4枚去油去锈的洁净铁钉,分别装入下表的试管中,进行实验:
实验 图示 |
|
|
|
|
生锈时间 | 8小时 | 5小时 | 3小时 | 1小时 |
(1)通过上述实验可知,温度越高铁钉生锈速率越_____(填“慢”或“快”);在_____(填“酸性”、“碱性”或“中性”)环境中铁钉生锈速率较快。
(2)金属锈蚀造成的损失巨大,对金属锈蚀的控制尤为重要,下列对金属的防护措施合理的是_____(填序号)。
a 齿轮表面涂油 b 将钢材深埋保存 c 将钢刀浸泡在水中 d 车圈镀铬
查看答案和解析>>
科目: 来源: 题型:
【题目】归纳是化学科学研究中常用的一种方法。在进行归纳之前。常需要以大量的实验事实作为基础。探究氧气的化学性质;如图所示,是探究氧气性质的一组实验,试回答下列问题:
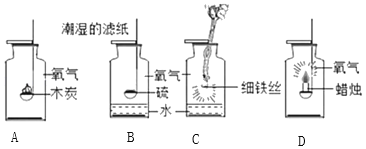
(1)A实验若要检验生成物,需要进行的操作是_____,发生反应的化学方程式为_____。
(2)B实验中潮湿的滤纸和水的共同作用是_____,将水换成氢氧化钠溶液效果更好,试推测可能的原因是_____。
(3)C实验中水的作用是_____。
(4)D实验中涉及的化学反应与其他三个反应有所不同,它属于_____(填“化合反应”或“氧化反应”)。
(5)以上实验将可燃物放入集满氧气的集气瓶中燃烧时均应该注意的一点实验操作是_____。
(归纳与交流)
①上述可燃物在氧气中燃烧通常比在空气中剧烈,说明氧气的化学性质比较_____(填“活泼”或“稳定”)。
②我们将上述物质与氧气的反应称为氧化反应,可以根据其反应的剧烈程度分为剧烈氧化(如燃烧)和缓慢氧化,下列变化属于缓慢氧化的是_____(填序号)。
A 动植物的新陈代谢
B 金属器皿的锈蚀
C 石油的分馏
D 食物的腐烂
E 有机肥的腐熟
F 煤的干馏
查看答案和解析>>
科目: 来源: 题型:
【题目】化学课上,同学们做了三组实验来探究碱的化学性质。
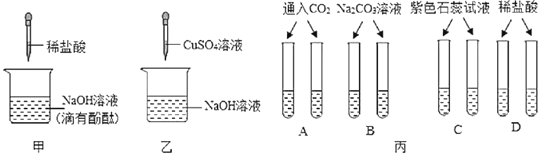
(1)甲实验中逐滴滴加稀盐酸,边滴加边用玻璃棒搅拌,至烧杯中溶液刚好变为无色,若要证明此时氢氧化钠和盐酸恰好完全反应,还需设计的实验方案是(简述实验操作及现象)_____。
(2)乙实验中发生反应的化学方程式为_____。
(3)丙实验中,可用来鉴别NaOH溶液和Ca(OH)2溶液的是_____(填字母)。
查看答案和解析>>
科目: 来源: 题型:
【题目】微观粒子模型化是研究化学变化的重要方法。
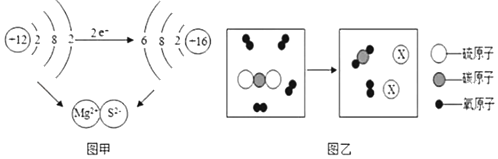
(1)图甲是镁与硫反应生成硫化镁的示意图,该图说明在化学反应过程中一定发生变化的是_____(填字母)。
A 原子核 b 原子的最外层电子数 c 原子的电子层数
(2)某反应的微观示意图如图乙所示
①请你画出微粒X的图示_____。
②根据上述微观示意图,可得出化学反应遵循质量守恒定律的本质原因是_____。
③图乙的反应可表示为CS2+3O2![]() 2SO2+CO2,其中化合价发生变化的元素是硫和氧两种元素,请分别表示出它们的化合价变化的情况_____。
2SO2+CO2,其中化合价发生变化的元素是硫和氧两种元素,请分别表示出它们的化合价变化的情况_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示装置可用于洗气、集气、验气和储气等多种用途(视实验需要,瓶中可装入不同物质)。下列四个实验中均要使用该装置,则气体或水入口为y的是( )
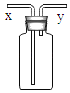
A. 瓶中装有适量的NaOH溶液,除去氢气中含有的少量二氧化碳气体
B. 瓶中装满水,用排水集气法收集氧气
C. 瓶中装有澄清石灰水,检验一氧化碳气体中是否混有二氧化碳
D. 瓶中装有氧气,将水从导气管通入以取用瓶内储存的气体
查看答案和解析>>
科目: 来源: 题型:
【题目】铜及其化合物在生产、生活中都有广泛的应用。
一、铜的冶炼
资料一:考古工作者从安阳的商代铸铜遗址中,发现当时冶炼铜的主要矿物原料是孔雀石[主要成分是碱石碳酸铜Cu2(OH)2CO3],主要燃料是木炭,冶炼温度估计在1000℃左右。
资料二:西汉刘安著《淮南万毕术》中记载“曾青得铁则化为铜”。“曾青”可能是硫酸铜一类的物质,将孔雀石溶于硫酸中得此溶液,当把铁粉投入此溶液中即可得铜。
(1)关于“曾青”和孔雀石的说法中,正确的是___。
A 前者属于盐,后者的主要成分是碱 B 前者属于酸,后者的主要成分是碱
C 前者和后者的主要成分都属于氧化物 D 前者和后者的主要成分都属于盐
(2)以孔雀石为原料的冶炼过程中,用现代化学的观念审视,可能涉及的化学反应有__。
①Cu2(OH)2CO3![]() 2CuO+CO2↑+H2O ②2CuO+C
2CuO+CO2↑+H2O ②2CuO+C![]() 2Cu+CO2↑
2Cu+CO2↑
③CuO+CO![]() Cu+CO2 ④CO2+C
Cu+CO2 ④CO2+C![]() 2CO
2CO
A ①② B ①③ C ①②③ D ①②③④
(3)已知有元素化合价升高和降低的反应属于氧化还原反应。在(2)的四个反应中,不属于四种基本反应类型的有(填序号,下同)____,不属于氧化还原反应的有____。
(4)资料二中,假设溶解孔雀石的酸是稀硫酸,写出用此方法冶炼铜的化学方程式:___,___。
二、铜及其化合物的应用
(5)碱式碳酸铜是一种具有广泛用途的化工产品,主要用于固体荧光粉激活剂和铜盐的制造等。碱式碳酸铜由Na2CO310H2O与CuSO45H2O反应制备,原理:2CuSO4+2Na2CO3+H2O=Cu2(OH)2CO3↓+2Na2SO4+CO2↑。称取14.0gCuSO45H2O、16.0gNa2CO310H2O,用研钵分别研细后再混合研磨,立即发生反应,有“嗞嗞”声,而且混合物很快成为“黏胶状”。将混合物迅速投入200mL沸水中,快速搅拌并撤离热源,有蓝绿色沉淀生成,过滤,用水洗涤,至滤液中不含SO42﹣为止,取出沉淀,风干,得到蓝绿色晶体。
①混合物发生反应时有“嗞嗞”声的原因是___。
②撤离热源的目的是___。
组成测定:
有同学查阅资料发现用Cu(OH)2CuCO3表示碱式碳酸铜是不准确的,较为准确、科学的表达式是mCu(OH)2nCuCO3,不同来源的碱式碳酸铜的m、n值需要具体测定。热分解法测定碱式碳酸铜组成的实验装置如下图所示,通过测定碱式碳酸铜在灼热后所产生的气体体积,推导出碱式碳酸铜中碳酸铜和氢氧化铜的含量,即可求出m和n的比值。
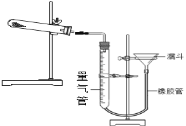
③三次平行实验测定结果如下表,则该样品中m:n=___,若量气管中所盛液体是水,则该测定值比理论值___(填“偏大”、“偏小”或“不变”)。(已知该状况下,二氧化碳密度为1.964g/L)
实验序号 | 样品质量/g | CO2体积/mL (已折算成标准状况下) |
1 | 0.542 | 44.82 |
2 | 0.542 | 44.80 |
3 | 0.542 | 44.78 |
查看答案和解析>>
科目: 来源: 题型:
【题目】日常生活、社会发展与化学密切相关。

Ⅰ.(1)有些青少年不爱吃蔬菜、水果,影响生长发育,这主要是由于摄入__(填序号)不足而引起的。
①维生素 ②油脂 ③蛋白质
(2)“××糕点”主要营养成分如图所示。请根据该表回答。
①所含营养素中属于无机盐的是___(写化学式)。
②其中提供能量的营养素有蛋白质、___、糖类。
③食用300g该糕点,为人体提供钙元素的质量是____mg
(3)直接参与人体新陈代谢活动的糖类是__(用化学式表示),自然界产生该物质过程的名称叫___。
Ⅱ.(1)生铁和钢都是铁的合金,从组成上看,二者性能不同的原因是___;
(2)厨房中的下列物品所使用的主要材料属于无机材料的是___;
A 陶瓷碗 B 不锈钢炊具 C 橡胶手套 D 铜质水龙头
(3)某录音录带磁粉中含有化学组成相当于CoFe2O4的化合物,又知钴(Co)和铁都有+2、+3价,且在上述化合物中每种元素只具有一种化合价,则铁元素的化合价为____;
(4)波尔多液是一种农业上常用的杀菌剂,它由硫酸铜、生石灰加水配制而成,其中的化合反应是___(用化学方程式表示);
(5)某实验室废液中含有稀硫酸、硫酸亚铁和硫酸铜,若向其中加入一定量的锌,充分反应后过滤,向滤渣中加入盐酸,有气泡产生,则滤液中一定不含有的物质是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】由煤制氢气的技术发展已有200年历史。某实验室提出了一种煤制氢技术。其流程如图所示。

(1)水煤浆是由煤与水混合而成,经过气化器后转化为CO2和H2。在气化器中发生了两个反应:①C+H2O![]() CO+H2 ; ②_____+_____
CO+H2 ; ②_____+_____![]() CO2+H2;煤属于___(填“纯净物”或“混合物”),属于___(填“可再生”或“不可再生”)能源,②的化学方程式是___;
CO2+H2;煤属于___(填“纯净物”或“混合物”),属于___(填“可再生”或“不可再生”)能源,②的化学方程式是___;
(2)煅烧炉中发生的反应方程式___;
(3)重整器的作用是除去氢气中混有的___。
(4)在氢气、氮气、二氧化碳中,会引起温室效应的是___(写化学式,下同), “无污染的能源”是___,空气中体积分数最大的是___;
(5)目前氢能的开发与利用面临的困难有___;
A 成本比汽油燃料成本高 B 运输储存难 C 容易爆炸,不够安全
(6)燃料电池里发生的反应为:2H2+O2=2H2O,为了维护电池的正常工作,需要定期排放所生成的水。100kg氢气通入燃料电池,理论上可生成水___kg。
查看答案和解析>>
科目: 来源: 题型:
【题目】自来水厂常用氯气杀菌消毒,用明矾、氯化铁等净化水。以硫铁矿(主要成分是FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的流程如下图所示:
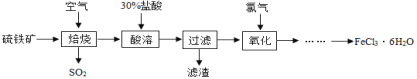
(1)“焙烧”前将硫铁矿进行粉碎,其目的是___。
(2)已知“焙烧”阶段就是硫铁矿的燃烧,生成物是Fe2O3和SO2,写出该反应的化学方程式__。
(3)大量排放出SO2能形成酸雨,危害环境。常用下列方法除去:
方法1:将含SO2的废气通入氨水中,以减少空气污染,反应的化学方程式为:2SO2+4NH3H2O+O2=2__+2H2O。某兴趣小组测定了不同溶质质量分数的氨水在不同温度下吸收SO2气体的情况,获得如下图象,从实验数据可知,吸收SO2最佳的生产条件是__、__;

方法2:将含有二氧化硫的废气通入石灰石悬浊液中,在空气作用下生成硫酸钙和二氧化碳,从而除去二氧化硫。写出该反应的化学方程式____。
(4)流程中用30%盐酸“酸溶”焙烧后的残渣,写出化学方程式____;若在实验室欲用质量分数为37%(密度为1.18 g/ml)的盐酸配制30%的100g盐酸,则需要加水___g(保留1位小数),需要的玻璃仪器有烧杯、___、___胶头滴管等。
(5)“氧化”后从FeCl3溶液中获得FeCl3·6H2O晶体的操作方法是:在HCl气流中蒸发浓缩、____、过滤、洗涤、干燥。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com