
科目: 来源: 题型:
【题目】如图是甲转化为丙的微观过程,下列说法不正确的是( )
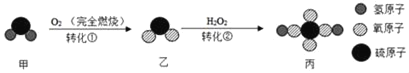
A. 转化①中甲和O2反应的分子个数比为1:1
B. 丙中硫元素的化合价是+6价
C. 转化②是化合反应
D. 反应前后原子种类不变
查看答案和解析>>
科目: 来源: 题型:
【题目】铁是人体必需的微量元素。它在元素周期表中的部分信息及原子结构示意图如图所示,下列说法正确的是( )
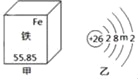
A. 乙图中m值为14
B. 铁的相对原子质量是55.85g
C. 铁原子中质子数是30
D. 铁原子在化学反应中易失去3个电子形成亚铁离子
查看答案和解析>>
科目: 来源: 题型:
【题目】草酸镍晶体(NiC2O4·2H2O)难溶于水,可用于制镍催化剂。
(探究一)某小组用废镍催化剂(主要成分含有Ni,还含有少量的Al2O3、Fe)制备草酸镍晶体的部分实验流程如下:
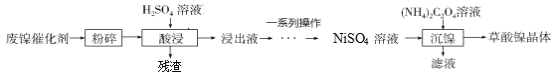
(1)“粉碎”的目的是 ______ 。
(2)“酸浸”的目的是为了得到NiSO4但会生成新的杂质,写出生成杂质的化学反应方程式: ______ (只写出一个即可)。
(3)“一系列操作”主要是为了除去溶液中铁元素对应的离子、 ______ (填写离子符号)等。
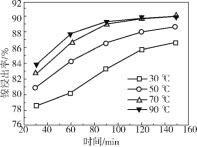
(4)保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率(硫酸镍的产率)随时间变化如图。从工业生产和能源利用率的角度分析,“酸浸”的最适宜温度与时间分别为 ______ (填字母)。
a 30℃、30min b 90℃、150min
c 70℃、120min d 90℃、120min
(5) “沉镍”后的滤液在农业中可用作 ______ 。
(6)“沉镍”过程如何证明Ni2+已沉淀完全 ______ 。
(7)将“沉镍”工序:①主要过程为:蒸发浓缩、 ______ 、过滤,所得固体用95%乙醇洗涤,得草酸镍晶体。
②用95%乙醇洗涤的目的是洗去杂质、 ______ 。
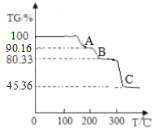
(探究二)对草酸镍晶体(NiC2O4·2H2O)晶体进行热重分析,温度与TG%的关系如图所示,
(查阅资料)①NiC2O4·2H2O加热至240℃左右完全失去结晶水;继续加热至320℃,剩余固体受热分解产生镍的氧化物、CO2和CO。
②TG% =![]()
A点物质的化学式 ______ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】(探究一)用铁屑按下列流程图制备硫酸亚铁晶体。

(1)反应器所在的厂房要加强通风的原因可能是 ______ 。
(2)滤液M中肯定含有的溶质的化学式是 ______ 、 ______ 。
(3)若在实验室中操作A的名称是 ______ ,完成该操作需要的玻璃仪器有玻璃棒、烧杯和 ______ 。操作A得到的固体残渣的主要成分是 ______ 。
(4)滤液M经过操作B可得硫酸亚铁晶体(FeSO4·7H2O)。已知硫酸亚铁的溶解度和析出晶体的组成如下表:
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 64 | 70 | 80 | 90 |
溶解度/g | 15.6 | 20.5 | 33.0 | 40.4 | 48.8 | 55.0 | 55.3 | 50.6 | 43.7 | 37.2 | 15.6 |
析出晶体 | FeSO4·7H2O | FeSO4·4H2O | FeSO4·H2O | ||||||||
根据溶解度表,获得硫酸亚铁晶体(FeSO4·7H2O)时,冷却结晶温度最高不超过 ______ ℃。
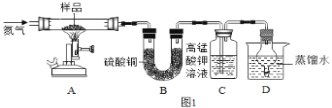
(探究二)某硫酸亚铁晶体(FeSO47H2O)热分解研究:该兴趣小组同学称取ag硫酸亚铁晶体样品按图1高温加热,使其完全分解,对所得产物进行探究。
(5)装置B中硫酸铜粉末变蓝,说明产物中有 ______ ,装置C中高锰酸钾溶液褪色,说明产物中还有 ______ 。
(6)硫酸亚铁晶体完全分解后装置A中固体呈红棕色,放入足量稀盐酸,固体全部溶解,得到黄色溶液,则装置A中红棕色固体是 ______ 。
(7)小明从理论上分析得出硫酸亚铁分解还生成另一物质SO3气体,他打算向装置D中滴入紫色石蕊试液检验生成了SO3,小红认为此法不能达到实验目的,小红作出这样判断的理由是 ______ 。
(8)装置D球形干燥管的作用 ______ 。
(9)根据以上实验事实,写出硫酸亚铁晶体受热分解的化学方程式 ______ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】合成氨是人类科学技术对社会发展与进步做出了巨大贡献.合成氨的工艺流程图如图1:
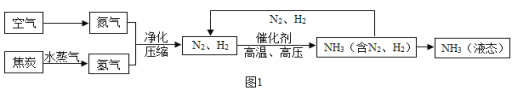
(1)空气中氮气的体积分数约为 ______ 。
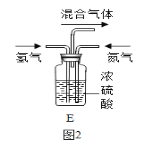
(2)写出N2、H2反应生成NH3的化学方程式 ______ 。已知同温同压下,相同数目的气体分子具有相同的气体体积,理论上氢气和氮气恰好完全反应时,则氢气和氮气的体积比为 ______ ,图2装置中的浓硫酸作用除了混合气体、通过导管口的气泡控制气体的流量的作用外,还有 ______ 作用。
(3)将沸点不同的气体分离开来,常采用液化分离法。根据下表中物质的沸点判断,要将产物NH3与N2、H2分离开来,最适宜的温度应该控制在 ______ .。
物质 | H2 | N2 | O2 | NH3 |
沸点 | -252℃ | -195.8℃ | -183℃ | -33.35℃ |
A -252℃≤t<-33.5℃ B -252℃≤t<-195.8℃ C -195.8℃≤t<-33.5℃
(4)该工艺流程中能循环利用的物质是 ______ 。
(5)实验室常用加热硫酸铵和熟石灰的固体混合物来制取氨气,写出该反应的化学方程式
______ ,实验室制取该气体的发生装置应选择下列装置中的 ______ (填字母代号),
用D装置收集氨气时,证明氨气集满常用 ______ 试纸放在 ______ 导管口(填“a”或“b”)
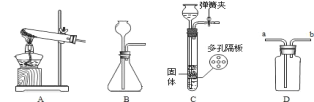
(6)实验室制取二氧化碳时发生反应的化学方程式 ______ ,上述装置中可用于制取二氧化碳气体发生装置的是 ______ (填字母代号)
查看答案和解析>>
科目: 来源: 题型:
【题目】与生产和生活密切相关,请结合实际填空。
(1)在人体组织里,葡萄糖在酶的催化作用下缓慢氧化放出能量,写出该反应的化学方程式______ 。
(2)婴儿配方奶粉中含有蛋白质、糖类、钙、铁、硒等营养成分,这里的钙、铁、硒是指______(填“元素”、“单质”或“化合物”)。该奶粉中的营养成分一定属于高分子的是 ______ 。
(3)常用洗涤剂清洗餐具上的油污,这是因为洗涤剂具有______的功能。
(4)取适量水样,加入肥皂水检验,若观察到水中产生较多浮渣,则该水样是______(填“硬水”或 “软水”)。
(5)大米、花生、面粉等发生霉变而产生的有毒物质是______ 。
(6)下列扬州特色食品中,含糖类较多的是 ______ (填序号)。
① 高邮咸鸭蛋 ②邵伯龙虾 ③扬州老鹅 ④“共和春”干拌面
(7)①某品牌自行车采用铝合金材料,金属铝具有较强抗腐蚀性的原因: ______ 。
②下列汽车配件及用品中,属于有机合成材料的是(填序号) ______ 。

A 钢铁外壳 b 合成纤维材质的安全气囊 c 汽车轮胎 d 羊毛座垫
查看答案和解析>>
科目: 来源: 题型:
【题目】松花蛋是人们喜欢的菜肴之一。生石灰、食盐、纯碱、硫酸锌是制作含锌松花蛋的主要原料,制作料泥时将上述原料加入水中,混合均匀即可。

(1)食醋中含有醋酸(CH3COOH),醋酸由 ______ (填数字)种元素组成,醋酸中碳元素的质量分数为 ______ 。
(2)原料中可以做干燥剂的物质是 ______ (填化学式)。
(3)原料中食盐在生活中最常用作调味品,常在其中加入碘酸钾(KIO3),碘酸钾中碘元素的化合价为 ______ ,加碘盐是否能检验淀粉 ______ (填“是”或“否”),人体缺锌元素会患有 ______ (填字母)。
A 佝偻病 b 贫血病 c 侏儒症 d 甲状腺疾病
(4) “纯碱”是 ______ (填物质的名称)的俗称,纯碱溶液的pH ______ 7(填“大于”、“小于”或“等于”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某无色气体X可能含有H2、CO、CO2和CH4中的一种或几种。为确认其组成,某同学 取一定量该气体按下图所示装置进行实验(假设每步都充分反应或吸收),结果装置①中变浑浊,装置③增重3.6g,装置④增重2.2g。关于气体X成分的①一定没有CO2;②一定有CO2,可能只有CH4;③一定有CO2,
可能含有CH4和H2;④一定有CO2,可能含有H2、CO和CH4。其中,正确的是
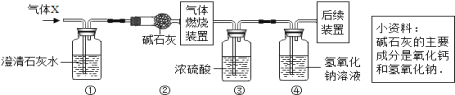
A. ①B. ②C. ③D. ④
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室测定蜡烛在盛有一定体积空气的密闭容器内燃烧至熄灭过程中,O2 和 CO 含量随时间变化曲线如图,通过分析该图可推理出的结论是
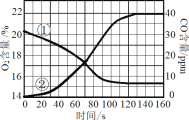
A. 曲线①表示 CO 含量的变化
B. 蜡烛发生了不完全燃烧
C. 蜡烛由碳、氢元素组成
D. 蜡烛熄灭时,容器内氧气没有耗尽
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com