
科目: 来源: 题型:
【题目】以CO2为碳源,与电解水产生的H2经催化可转化为高附加值的有机物,此方法具有重要的战略意义。中国化学家使用特殊的催化剂实现了CO2和H2转化为A或B等有机物,反应原理如下图所示:
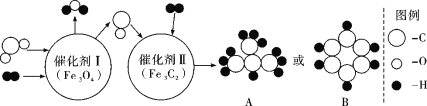
请回答下列问题:
(1)B的化学式是_________。
(2)根据催化剂的特性可知,催化剂在该反应前后,其质量和_________不变。
(3)在催化剂Ⅰ中发生反应的化学方程式是_________。
(4)由CO2 和H2反应生成A的总反应化学方程式是_________。
(5)如果该反应工业化生产后的重要意义是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】农作物秸秆属于农业生态系统中一种十分宝贵的生物质能资源。农作物秸秆综合利用对于促进农民增收、环境保护、资源节约以及农业经济可持续发展意义重大。秸秆的主要成分是纤维素[(C6H10O5)n]。
(1)纤维素分子中C、H、O原子个数比为_________。
(2)发电厂将秸秆粉碎压缩成颗粒,作为燃料用于发电。如果直接在农田中燃烧秸秆的主要危害是_________。
(3)将秸秆还田,可作为农家肥料,但某植物在生长过程中还需要施用复合肥。下列属于复合肥的是_________(填标号)。
A KNO3 B CO(NH2)2 C NH4NO3 D NH4H2PO4
(4)以秸秆为原料可生产出可降解塑料餐盒;该塑料属于_________(选填“合成有机高分子”、“天然有机高分子”、“合金”)材料
(5)利用秸秆可生产乙醇,加入到汽油中制成乙醇汽油。生产过程中涉及到如下反应C6H12O6![]() 2C2H5OH+2X↑,则X的化学式为_________。
2C2H5OH+2X↑,则X的化学式为_________。
(6)在农村,秸秆曾经作为燃料广泛使用,但秸秆不完全燃烧会产生_________气体与血液中的血红蛋白结合引起中毒。随着社会的进步,农村可以推广使用下列哪些能源替代秸秆作燃料_________。
A 沼气 B 天然气(或液化气) C 太阳能
查看答案和解析>>
科目: 来源: 题型:
【题目】已知4FeS2+11O2![]() 2Fe2O3+8X,则下列关于该反应说法错误的是
2Fe2O3+8X,则下列关于该反应说法错误的是
A. O2与X的相对分子质量之比为1∶2
B. 该反应属于置换反应
C. X属于空气污染物之一
D. 该反应中硫元素的化合价升高
查看答案和解析>>
科目: 来源: 题型:
【题目】硒元素是动物体必需营养元素和植物有益的营养元素。硒在元素周期表中的信息及原子结构示意图如图所示。下列关于硒元素的说法错误的是

A. 硒的原子序数为34
B. 硒的相对原子质量是78.96
C. 硒在化学反应中容易失去电子
D. 硒化氢的化学式是H2Se
查看答案和解析>>
科目: 来源: 题型:
【题目】阅读短文后回答下列问题。
燃料电池(Fuelcell),是一种使用燃料进行化学反应产生电能的装置,最早于1839年由英国的Grove发明。燃料的选择性非常多,包括纯氢气(H2)、甲醇(CH3OH)、乙醇(CH3CH2OH)、天然气,甚至于现在运用最广泛的汽油,都可以作为燃料电池的燃料。这是目前其他所有动力来源无法做到的。而以燃料电池做为汽车的动力,已被公认是二十一世纪必然的趋势。2017年,我国共有8个品牌的10款车型燃料电池汽车在产,总产量为1272辆,2018年国产燃料电池汽车已经超过3000辆。
燃料电池是以特殊催化剂作电极使燃料与氧气发生反应,生成二氧化碳和水。因其不需推动涡轮等发电器具,也不需将水加热至水蒸气再经散热变回水,所以能量转换效率高达70%左右,足足比一般发电方法高出了约40%;优点还不只如此,其二氧化碳排放量比一般方法低许多,且水又是无害的生成物,所以燃料电池是一种高效、低污染装置。
燃料电池主要由正极、负极、电解质溶液和外部电路4部分组成,其正极和负极分别通入燃料气和氧气(空气),负极上燃料气放出电子,外电路传导电子到正极并与氧气结合生成离子,在电场作用下,离子通过电解质转移到负极上再与燃料气进行反应,最后形成回路产生电能。与此同时,因为燃料自身的反应及电池存在的内阻,燃料电池也要排出一定的热量,以保持电池恒定的工作温度。右图是甲烷燃料电池的工作原理示意图。
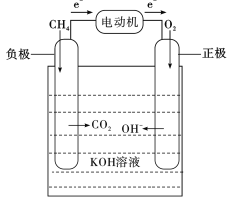
(1)燃料电池是将_________能转化为电能的装置。
(2)下列说法错误的是_________。
A 化学反应放出的能量可以是光能、热能、电能等
B 燃料电池可以广泛用于新能源汽车。
C 氢燃料电池汽车所需要的H2可电解水生成。
D 燃料电池都要排放CO2气体
(3)写出甲醇完全燃烧的化学方程式_________。
(4)甲烷燃料电池释放能量的总反应化学方程式是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某粗盐中除NaCl以外还含有少量杂质MgCl2,为了测定粗盐中MgCl2的质量分数。取固体样品50.0g完全溶解于150.0g水中,并向其中逐渐加入一定浓度的NaOH溶液,实验过程中生成沉淀的质量与加入NaOH溶液的质量的关系如图所示:

注:发生反应的化学方程式为:MgCl2+2NaOH=Mg(OH)2↓+2NaCl
请根据相关信息完成下列计算:
(1)反应完全时,生成氢氧化镁的质量为_____g;
(2)在粗盐中氯化镁的质量分数;_____
(3)恰好完全反应时得到的溶液中溶质的质量分数。_____
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)用化学用语填空
①2个氧原子:_____;
②钙离子:_____;
③+2价的镁元素:_____;
④1个氮分子:_____;
⑤五氧化二氮_____.
(2)写出下列化学反应的符号表达式:
铁丝在氧气中燃烧_____
过氧化氢和二氧化锰制取氧气_____.
查看答案和解析>>
科目: 来源: 题型:
【题目】如图1是甲、乙、丙三种物质的溶解度曲线.请看图回答.
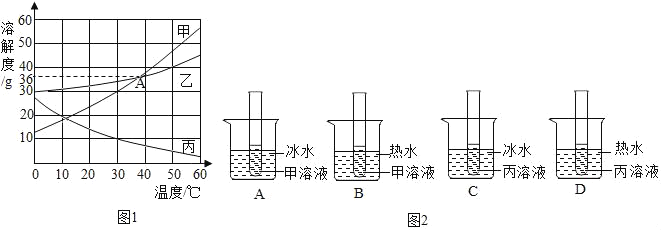
①20℃时,甲乙丙三种物质的溶解度由大到小的顺序_____
②图中A点表示的意义是_____.
③在室温时,将分别盛有甲、丙饱和溶液的试管各两支,分别放入盛有冰水或热水的烧杯中.根据甲、丙两物质的溶解度曲线,判断图2试管内所示现象正确的是_____(填字母序号),该现象被叫做_____.
查看答案和解析>>
科目: 来源: 题型:
【题目】已知氧化铜还原成铜的过程中有氧化亚铜生成。如图是小华同学用CO还原氧化铜的实验装置图,当玻璃管中黑色物质全部变红后,小华想知道红色物质中有哪些成分?请你与小华一起完成下面的探究。

【提出猜想】①全部是铜; ②全部是氧化亚铜;③是铜和氧化亚铜的混合物。
【查阅资料】氧化亚铜是一种红色固体,能与稀硫酸发生如下反应:
Cu2O+H2SO4=Cu+CuSO4+H2O
【设计实验】为了验证这些猜想,小华同学进行了以下探究活动,请完成下列问题:
步骤 | 现象或数据 | 结论 |
(1)称取14.4g反应生成的红色固体于试管中,向其中加入足量的稀硫酸; | 现象:_______; | 猜想①错误 |
(2)将步骤(1)反应后的物质进行过滤,称量干燥后的固体质量为m。 | 数据: 若m = 6.4g; | ________ |
数据:若m_______6.4g (填:>、<或=)。 | 猜想③正确 |
【交流反思】(1)小华实验装置中的石灰水的主要作用是______________________________,从环保角度看,该装置有待改进,请写出一种改进措施_____________________________。
(2)请写出氧化铜与CO反应生成氧化亚铜的化学方程式_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列实验装置图,回答问题:
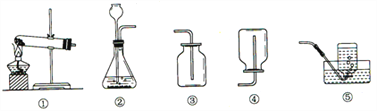
(1)实验室用高锰酸钾制氧气应选用的发生装置是_________(填序号,下同)。
(2)实验室制取二氧化碳选用的收集装置是__________________,验证二氧化碳收集满的方法是______________________________________________(写出操作、现象、结论)
(3)实验室收集某气体只能用装置④,由此说明该气体具有的物理性质是______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com