
科目: 来源: 题型:
【题目】阅读下列科普文章:通常情况下,钾具有银白色光泽,质地十分柔软,可以用小刀切割。钾的熔点很低,只有63℃,也就是说,只要温度升高到63℃,金属钾就变成水银般的液体了。钾的密度很小,它比水还轻。钾的化学性质十分活泼,与水反应剧烈,当把一块钾放入水中时,你就会看到它不断地浮起落下,周身还冒出火焰。一会儿再看,水中的钾就消失了。原来,它跟水发生反应生成了氢氧化钾。钾与酸的水溶液反应更加剧烈,几乎能达到爆炸的程度。回答下列问题:
(1)钾的物理性质有______、______、______、______。(至少答四点)
(2)钾的化学性质有______、______。
(3)写出下列反应的文字表达式:①磷的燃烧______,②铁的燃烧_____
查看答案和解析>>
科目: 来源: 题型:
【题目】我们知道铁在潮湿的空气中会发生锈蚀,而铜片在潮湿的空气中也会产生锈渍“铜绿”。为探究“铜绿”的组成及铜片锈蚀的原理,实验小组进行了一系列的实验。
(实验一)
(1)取少量“铜绿”于试管中,加入适量的稀盐酸,将产生的气体通入澄清石灰水中,澄清石灰水变浑浊,石灰水变浑浊的化学方程式是_________,可见“铜绿”中含有碳元素。
(实验二)
为进一步探究“铜绿”产生的原因,设计了如下系列实验。
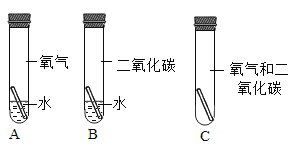
经过一段时间后,发现A、B、C试管均无明显的锈渍。
(2)有人根据铁的锈蚀原理,得出“铜的锈蚀是铜与空气中的水和氧气作用的结果”的结论,上述系列实验中_________项(填标号)可以证明这结论是错误的。
(实验三)
(3)改进A、B、C三项实验都能实现铜的锈蚀。如改进C的方法是:取下橡皮塞,注入适量的水,迅速塞紧橡皮塞。那么,改进A的方法是_________。
(实验结论)
(4)通过以上实验发现,铜的锈蚀是铜跟_________物质共同作用的结果。
(拓展交流)
(5)6.4g的铜转化为“铜绿”,其质量约为11.0g,将其加热至质量不再减少时,称得剩余固体的质量为8.0g,则剩余固体是_________(填标号)。
A CuO B Cu2O C Cu(OH)2
查看答案和解析>>
科目: 来源: 题型:
【题目】下列是常见制取和收集气体的装置。
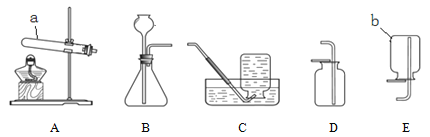
(1)仪器的名称:a是________,b是________。
(2)实验室用氯酸钾和二氧化锰制取氧气,可选用的发生和收集装置是_____和_____(填标号),反应的化学方程式为________,其中二氧化锰是________。
(3)实验室若用B装置制取二氧化碳,长颈漏斗末端要浸入液面以下的原因是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲、乙、丙是含碳元素的化合物,有关物质的转化关系如图所示。
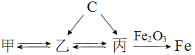
(1)若甲是含钙的化合物,其名称是________。
(2)乙的一种用途是________。
(3)从微观的角度解释乙和丙的化学性质不同的原因是________。
(4)写出丙与氧化铁高温下反应的化学方程式________。
查看答案和解析>>
科目: 来源: 题型:
【题目】水是生命之源,人类的生活离不开水。
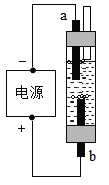
(1)如图是简易的水电解器,b端石墨电极产生的气体是________,该气体可用________检验。
(2)若装置中液体是氯化钠溶液,就是一款家用消毒液发生器,b端石墨电极会产生氯气(Cl2),氯气与水反应生成盐酸(HCl)和次氯酸(HClO),该反应的化学方程式为_________。
(3)下图为KNO3的溶解度曲线。
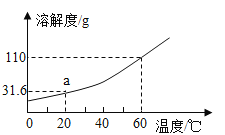
① a点表示的含义是_______。
② 60℃时,硝酸钾饱和溶液的溶质质量分数是________(结果精确到0.1%)。
③ 60℃时,210g硝酸钾饱和溶液降到20℃时,析出晶体的质量是________ g。
查看答案和解析>>
科目: 来源: 题型:
【题目】移走装置图中的玻璃片,会观察到集气瓶口有红棕色二氧化氮(NO2)气体生成。
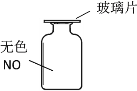
(1)一氧化氮属于________(填标号)。
A 混合物 B 化合物 C 单质 D 氧化物
(2)移走玻璃片,无色NO与氧气化合生成了NO2,写出该反应的化学方程式________。
(3)二氧化氮中氮、氧元素的质量比是________。
(4)红棕色NO2气体会逐渐扩散,请从微粒特性的某一角度进行解释________。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列实验装置图,回答问题:
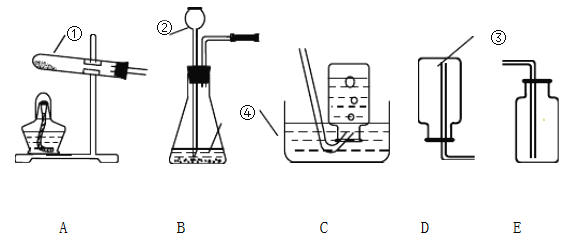
(1)写出图中标有序号的仪器名称:① ;② ;③ ;④ ;
(2)写出实验室用B装置制取氧气的文字表达式 。
(3)用氯酸钾和二氧化锰制取并收集氧气,所需发生装置是(填字母编号) ,反应的文字表达式是 。
(4)实验室制取氧气的操作步骤一般可以分为:① 点燃酒精灯,加热试管;②检查装置气密性;③将氯酸钾和二氧化锰混合物装入反应器,用带导管的橡皮塞塞紧试管,并固定在铁架台上;④用排水法收集氧气;⑤熄灭酒精灯;⑥将导管从水槽中移出。其正确的操作顺序是( )(填序号)
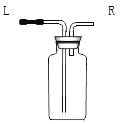
(5)通过查阅资料得知:①氨气(NH3)是一种密度比空气小且极易溶于水的气体,其水溶液称为氨水;②氨气在加热条件下能与氧化铜反应生成铜、水和空气中含量最多气体。小芳同学加热氯化铵和氢氧化钙的固体混合物制取氨气,她应该选择的发生装置是 ;收集装置是 (填字母编号)。若选择下图所示装置来收集氨气,则气体应从___________(填“L”或“R”)端通入。
查看答案和解析>>
科目: 来源: 题型:
【题目】有A、B、C、D四种元素,已知A、B、C、D的核电荷数依次增大,A的原子核内只有1个质子;黑色单质B可在C的单质中燃烧,生成一种能使石灰水变浑浊的气体;D是地壳中含量第二的金属。
(1)A、B、C、D的元素名称分别是
A: B:
C: D.
(2)写出下列化学反应的符号表达式:
①B单质在C单质中燃烧:
②D单质在C单质中燃烧:
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室常用的干燥剂有浓硫酸、碱石灰(CaO和NaOH的固体混合物)等,后者在潮湿的空气中易变质。某化学兴趣小组对实验室中一瓶久置的碱石灰展开探究。
[查阅资料]①碱石灰易吸收空气中的水蒸气和二氧化碳 ②氯化钙溶液呈中性,碳酸钠溶液呈碱性 ③碳酸钠和氢氧化钙溶于水温度变化不明显 ④Ca(OH)2分解温度为580℃,CaCO3分解温度为825℃,Na2CO3的分解温度为1744℃。
[提出问题]碱石灰是否变质?其成分可能有哪些?
[进行猜想]①若没有变质,碱石灰吸水性良好,成分只有CaO和NaOH;
②若变质,该碱石灰中可能含有CaO、NaOH、Ca(OH)2、Na2CO3、CaCO3中的两种或两种以上。
[实验过程]
(1)验证碱石灰是否变质:图中的B为干燥装置,常用于固体干燥剂干燥气体。现用A、B装置检验碱石灰是否变质,取适量的无水硫酸铜和碱石灰样品分别装入A、B中,连接好A、B装置,从 ____(填“c”或“d”)端向B中缓缓通入水蒸气,观察A装置中的现象为____,证明碱石灰已变质。
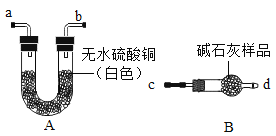
(2)验证碱石灰是否完全变质:取适量碱石灰样品放入试管中,加入足量蒸馏水使其充分溶解,溶液变浑浊,用手触摸试管外壁,温度无明显变化,证明碱石灰已完全变质。则样品成分最多有___种可能性(填数字)。
(3)为进一步确定碱石灰样品的成分,该小组继续实验并记录如下:
实验编号 | 实验操作 | 实验目的、现象或数据 | 实验结论 |
实验一 | ①取适量样品于试管中,加入足量蒸馏水使其充分溶解; ②过滤,得到滤渣A和滤液B;③向滤液B中加入足量CaCl2溶液,静置; ④________。 | 操作③的主要目的是:___ 操作④的现象:____ | 样品中一定有Ca(OH)2 |
实验二 | ①取干燥样品50g,控制在600℃内,加热至质量不再发生变化,冷却后称量; ②将①中剩余固体控制在850℃内反复加热,冷却后称量。 | 操作①中称得固体质量为45.5g;操作②固体质量无变化。 | 样品中一定没有_____(填化学式) |
[探究结论] 通过整个探究活动分析得知碱石灰样品的成分是______(填化学式),其中盐的质量分数为_____。
[反思与评价] 通过探究活动,大家知道该碱石灰变质的化学反应过程,其中生成盐的化学方程式为______;明白了碱石灰要密封保存的原因。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是常见气体的制取和收集装置,请按要求填空:
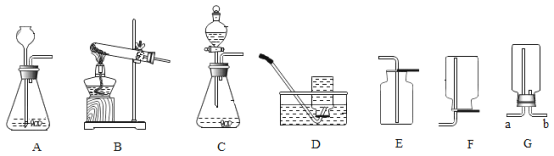
(1)图中可以制取氧气的发生装置有____,装置A和C相比,C的优点是____。
(2)实验室制取二氧化碳的化学方程式______。
(3)用G装置收集二氧化碳时,与发生装置连接的导管口为____(填“a”或“b”),验证已收集满的方法和现象为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com