
科目: 来源: 题型:
【题目】为测定某放口放置的氢氧化钠溶液的变质情况,某同学实验并记录如图:
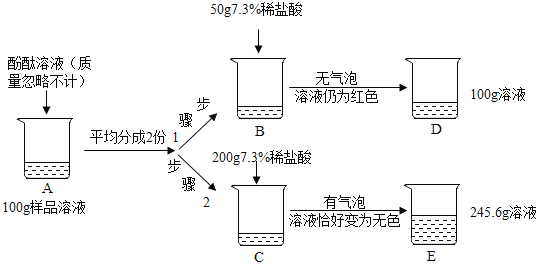
(1)配置如图实验步骤1所用的稀盐酸,需要质量分数为36.5%的浓盐酸的质量是______;
(2)B烧杯中发生反应的化学方程式为_______;
(3)根据已知条件求解A烧杯溶液中碳酸钠质量分数_______(写出解题过程);
(4)D烧杯溶液中溶质的化学式为_______;(不考虑酚酚酞)
查看答案和解析>>
科目: 来源: 题型:
【题目】鸡量主要由蛋壳、蛋壳膜、蛋白、蛋黄等几个部分组成,其中蛋壳的主要成分是CaCO3,里一层蛋壳膜。化学活动兴趣小组的同学开了以下探究活动:
(提出问题)蛋壳中的 CaCO3含量是多少?
(查阅资料)
a、蛋壳经过科学检测其中含CaCO3的质量分数的为82%~85%,含蛋白质质量分数的14-17%
b、蛋壳膜中蛋白质含量的为90%~93%。
c、Ba(OH)2是一种碱,化学性质与Ca(OH)2相似。
(设计方案)
方案一:用“灼烧法”,将该蛋壳放在空气中充分灼烧并采集相关数据进行测定。
方案二:用“酸处理法”,将蛋壳与稀盐酸反应后再进行吸收转变为碳酸钡进行测量处理。
(进行实验)
方案一:称取12.0g蛋壳研磨成粉末置于通风橱中,灼烧至质量不再减少,再称量剩余固体的质量为7.16g
方案二:用图2所示的连接实验装置。称取12g蛋壳样品进行实验(假设其他成分均不与HCI反应,装置内试剂均足量。)
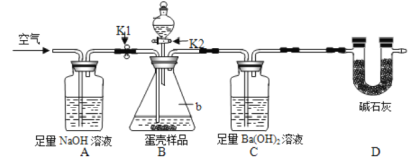
(实验步骤)
①按如图连接好装置后,并____________;
②向B装置中加入蛋壳样品后,先通入一会儿空气;
③关闭K1,打开K2,向蛋壳样品中滴入10%的盐酸,直到________为止;
④关闭K2,打开K1,再缓缓通入空气一会儿,至装置C中不再产生沉淀为止;
⑤将装置C中的固液混合物进行过滤、洗涤、烘干后称量其质量;
⑥重复上述实验
(数据处理)
方案一:产生的CO2质量_______g,蛋壳中CaCO3的质量分数为_______。(保留一位小数)
方案二:重复3次实验,记录数据如下:
实验次数 | 第1次 | 第2次 | 第3次 |
装置C中沉淀质量(/g) | 19.68 | 19.75 | 19.67 |
方案二中重复进进行实验的目的__________;生成沉淀的化学方程式是_________。实验测得蛋壳中的CaCO3的质量分数为________。
(评价反思)
(1)方案二中装置D的作用是_________。
(2)方案一测定值与科学检测的数据有较大误差,主要原因是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室以MnO2为原料制备少量高纯MnCO3的流程如下:
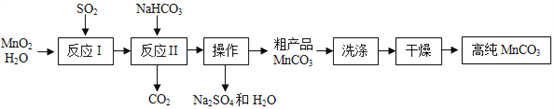
已知:①反应Ⅰ的化学方程式:MnO2+SO2═MnSO4;
②MnCO3、Mn(OH)2均难溶于水,MnCO3在100℃时开始分解.
(1)反应Ⅰ属于基本反应类型中的______________反应.
(2)流程中“操作”的名称为___________,所需要的主要玻璃仪器有__________.
(3)反应Ⅱ的化学方程式为_______________________.反应Ⅱ需控制溶液的酸碱性,若碱性过强,MnCO3粗产品中将混有______________(填化学式).
(4)验证MnCO3粗产品表面附着有Na2SO4杂质:取样品少许,向其中加入水,搅拌、过滤,向滤液中加入适量的______________(填化学式)溶液,有白色沉淀产生.
(5)为获得高纯MnCO3,需选择“低温”干燥的原因是_______________________.
查看答案和解析>>
科目: 来源: 题型:
【题目】元素周期表是学习化学的重要工具,在宏观、微观、符号之间建立联系是学习化学特有的思维方式。如图表示元素周期表的一部分,请回答下列问题:
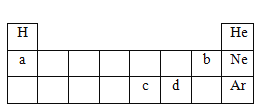
①表中a、b所代表的元素位于同一周期的原因是________。
②表中c、d元的原子化学性质不同的主要原因是_______。
③随着新元素的不断发现现,元素周期表还将逐渐完善。最近,科学家用大量高速钙原子菱击铕原子,得到了117号元素的原子,该元素原子核中一定含有117个________(填粒子种类)。
(2)在稀盐酸中加入过量锌粒的实验中:
①宏观现现象:可以观察到的主要现象为_________,固体逐渐溶解。
②符号表达:写出该反应的化学方程式:_________。
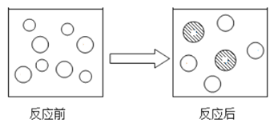
③微观理解:下图表示反应前后溶液中的主要离子,写出图中符号表示相应离子的符号:![]() 表示__,
表示__, ![]() 表示______。
表示______。
查看答案和解析>>
科目: 来源: 题型:
【题目】在密闭容器内进行的某反应中,测得反应前(t0)、反应中(t1)、反应后t2)不同时甲、乙,两、丁四种物质的质量分数分别如图所示,则下列说法不正确的是
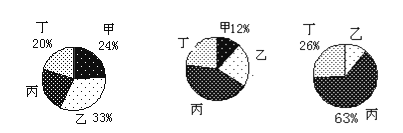
A.若甲和丁分别是镁和和碳,则该反应中甲和丁的化学计量数之比为1:2
B.若反应前甲、乙、丙、丁四种物质的总质量为100克,则再增加12克甲,甲与乙则恰好完全反应
C.该反应既不可能是化合反应,也不可能是分解反应
D.t1时刻,乙、丙、丁所占的质量分数分别为22%、43%和23%
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是甲、乙固体的溶解度曲线,下列说法正确的是
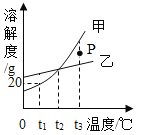
A.图中P点所表示的溶液是t3℃时甲的饱和溶液
B.可用t1℃时20%的甲溶液加水配制成10%的甲溶液
C.若甲中含有少量乙,可采用冷却热饱和溶液的方法提纯甲
D.分别将t3℃等质量的甲、乙饱和溶液降温至t2℃,所得溶液中溶质质量相等
查看答案和解析>>
科目: 来源: 题型:
【题目】在实验室里,小明看到氢氧化钠试剂瓶口有白色粉末,为探究其成分,他取少量该粉末溶于水,得到无色溶液,进行了如下实验,请结合实验回答下列问题。
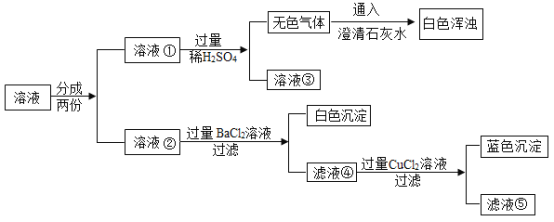
(1)该白色粉末的成分是_____;
(2)在溶液②中加过量![]() 溶液的目的是_____;
溶液的目的是_____;
(3)实验中,用_____溶液代替![]() 溶液也能达到实验目的;
溶液也能达到实验目的;
(4)实验后,将溶液③和滤液⑤都倒入同一个废液缸中,静置后,缸底有白色沉淀,取少量上层溶液,向其中加适量的![]() 溶液,无明显变化。综合分析,废液缸里上层溶液中一定含有的物质是_____,确定“一定不含的物质”所依据的现象是_____。
溶液,无明显变化。综合分析,废液缸里上层溶液中一定含有的物质是_____,确定“一定不含的物质”所依据的现象是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】通常粗盐的主要成分为NaCl,还含有少量的![]() 、
、![]() 以及泥沙等杂质。为了除去杂质,获得精盐,并用所得精盐配制一定溶质质量分数的NaCl溶液。实验室进行提纯的流程图如下,请回答下列问题。
以及泥沙等杂质。为了除去杂质,获得精盐,并用所得精盐配制一定溶质质量分数的NaCl溶液。实验室进行提纯的流程图如下,请回答下列问题。
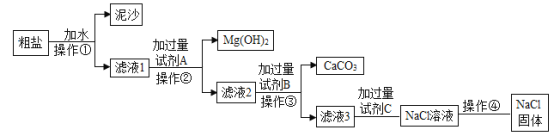
(1)操作①②③的名称是_____;
(2)滤液③中的溶质是_____;
(3)下列说法中,正确的是_____。
A 加水溶解粗盐时,用玻璃棒搅拌的目的是增大NaCl的溶解度
B 操作①②③中使用玻璃棒的作用是引流
C 操作④中蒸发滤液时,待蒸发皿中滤液蒸干才可以停止加热
D 配制NaCl溶液要经过计算、称量和量取、溶解、装瓶贴标签等步骤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com