
科目: 来源: 题型:
【题目】某同学用如图总结NaOH的四类化学性质(即NaOH能够与四类物质发生化学反应)。
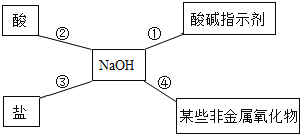
(1)为验证性质①,该同学将无色酚酞试液滴入NaOH溶液中,溶液颜色由无色变成_______________。
(2)性质②的反应为______________反应(非基本反应类型),试写出NaOH与盐酸反应的化学方程式_______________。
(3)为了验证性质③,该同学可选择的物质是_______________(填序号)
A Na2CO3 B CO2 C FeCl3 D Ba (NO3) 2
(4)写出NaOH溶液吸收CO2的化学方程式_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】A~G是初中化学常见的物质,已知A、D、F均为单质,其中D是日常生产生活中使用最多的金属,B是一种氧化物,C是一种常见的酸,E (相对分子质量为160)的水溶液呈蓝色,它们相互转化关系如图所示(部分生成物和反应条件已略去)。试回答下列问题:
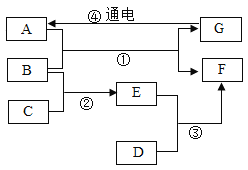
(1) B的化学式:_________________。
(2) A在生产生活中的一种用途_________________。
(3)写出②的化学方程式_________________。
(4)反应③的化学方程式_________________;图中所涉及到的反应中,与③属于同种基本反应类型的是___________;(填序号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】农作物秸秆属于农业生态系统中一种十分宝贵的生物质能资源。农作物秸秆综合利用对于促进农民增收、环境保护、资源节约以及农业经济可持续发展意义重大。秸秆的主要成分是纤维素[(C6H10O5)n]。
(1)纤维素分子中C、H、O原子个数比为_________。
(2)发电厂将秸秆粉碎压缩成颗粒,作为燃料用于发电。如果直接在农田中燃烧秸秆的主要危害是_________。
(3)将秸秆还田,可作为农家肥料,但某植物在生长过程中还需要施用复合肥。下列属于复合肥的是_________(填标号)。
A KNO3 B CO(NH2)2 C NH4NO3 D NH4H2PO4
(4)以秸秆为原料可生产出可降解塑料餐盒;该塑料属于_________(选填“合成有机高分子”、“天然有机高分子”、“合金”)材料
(5)利用秸秆可生产乙醇,加入到汽油中制成乙醇汽油。生产过程中涉及到如下反应C6H12O6![]() 2C2H5OH+2X↑,则X的化学式为_________。
2C2H5OH+2X↑,则X的化学式为_________。
(6)在农村,秸秆曾经作为燃料广泛使用,但秸秆不完全燃烧会产生_________气体与血液中的血红蛋白结合引起中毒。随着社会的进步,农村可以推广使用下列哪些能源替代秸秆作燃料_________。
A 沼气 B 天然气(或液化气) C 太阳能
查看答案和解析>>
科目: 来源: 题型:
【题目】酸、碱、盐在生产、生活中有广泛的应用。
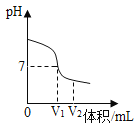
(1)氢氧化钠溶液与稀硫酸反应时,溶液pH变化如图所示。
①根据图示判断该实验是将__________滴入到___________中。
②滴入溶液体积为V2mL时,溶液中溶质为________________(填化学式)。
(2)测定某酸溶液pH时,如果放pH试纸的玻璃片上的水没有擦干就进行测定,会使测得的pH________(填“偏大”或“偏小”)
(3)本实验要将80g10%的氢氧化钠溶液恰好完全反应,需要一定质量,一定质量分数的硫酸溶液;如果改为等质量,等质量分数的盐酸与该氢氧化钠溶液反应,则反应完滴加几滴紫色石蕊溶液后呈__________色。
查看答案和解析>>
科目: 来源: 题型:
【题目】妈妈为小华准备了一份晚餐,有米饭、清蒸鱼、豆腐汤、京酱肉丝。
(1)上述食物中富含淀粉的是____________。 为了营养均衡,应添加的菜为___________(填“凉拌黄瓜”或“炖排骨”)
(2)烹调中使用了加铁酱油,酱油中加“铁”是为了防止缺铁引起的_______________;
(3)餐桌上的餐具有竹筷,塑料水杯、不锈钢勺子,其中制作竹筷的材料属于____________(填“合成”或“天然”)材料。
(4)晚饭后,小华用保鲜膜将剩饭菜包好,保鲜膜具有____________(填“热塑性”或“热固性”)。
(5)在日常生活中常用一些铝制器皿,在清洗铝制器皿表面的污垢时,不能使用热的碱性溶液,因为铝能与热的碱性溶液中的氢氧化钠、水发生作用而被腐蚀,生成偏铝酸钠(NaAlO2)和一种可燃性气体。该反应的化学方程式为________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有一不纯的Na2CO3样品,杂质可能是K2CO3、FeCl3、CaCO3和NaCl中的一种或几种,取该样品10.6克,加入足量的稀盐酸完全反应得到无色溶液,同时产生4.48克气体,下列判断正确的是( )
A. 杂质一定有FeCl3和CaCO3
B. 杂质一定没有NaCl
C. 杂质可能是K2CO3、CaCO3和NaCl组成
D. 杂质可能是K2CO3和NaCl组成
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图象能正确反映对应操作的是( )
A. 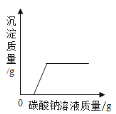 向一定质量的氯化钙溶液中加入碳酸钠溶液
向一定质量的氯化钙溶液中加入碳酸钠溶液
B. 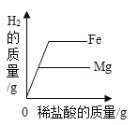 分别向足量的稀盐酸中加等质量的铁和镁
分别向足量的稀盐酸中加等质量的铁和镁
C. 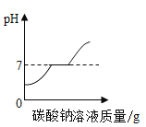 向氯化钙和盐酸的混合溶液中加入过量的碳酸钠溶液
向氯化钙和盐酸的混合溶液中加入过量的碳酸钠溶液
D.  向硝酸银和硝酸铜混合溶液中加入过量的锌粉
向硝酸银和硝酸铜混合溶液中加入过量的锌粉
查看答案和解析>>
科目: 来源: 题型:
【题目】甲、乙、丙三种物质的转化关系如图所示,“→”表示反应可以一步实现(部分物质和反应条件已省略),下面选项中不能按图示转化关系实现的是
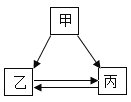
选项 | 甲 | 乙 | 丙 |
A | H2SO4 | H2O | H2 |
B | NaOH | NaCl | NaNO3 |
C | C | CO2 | CO |
D | Ca (OH) 2 | CaCl2 | CaCO3 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】人类历史发展的不同阶段曾以不同金属材料的使用作为标志。

(1)金、银在自然界有单质形式存在,说明它们的化学性质_____;
(2)在生产生活实践中,人类逐渐掌握了多种金属的冶炼技术。
①比较两种铁矿石:磁铁矿(主要成分 Fe3O4)和菱铁矿(主要成分 FeCO3),从化学的角度分析“磁铁矿作炼铁原料更具优势”,其原因是______;
②铝制品应用广泛,不易被腐蚀,是因为______(用化学方程式来表示);
(3)镁铝合金被誉为“21 世纪绿色金属结构材料”。一种镁铝合金 Mg17All2 是特殊的储氢材料,完全吸收氢气后得到 MgH2 和 Al,该反应的化学方程式为_____;
(4)钛和钛合金是 21 世纪的重要的金属材料。钛合金制品放在海水中数年,取出后仍光亮如新,是因为其_____(填字母序号)非常好;
A 可塑性 B 机械性能 C 抗腐蚀性能
(5)铁在潮湿的空气中易生成疏松的铁锈。已知:2FeCl3+Fe=3FeCl2
①铁锈的主要成分是________(填化学式),将生锈的铁制品放入一定量的稀盐酸中充分反应,变化过程中最多涉及______种化学反应基本类型;
②将 10g 表面生锈的铁钉(杂质已忽略)浸泡在 100g 溶质质量分数为 7.3%的稀盐酸中充分反应,观察到铁锈已完全消失。反应停止后,取出光亮的铁钉洗涤、干燥、称量,质量为 3.6g。则原生锈铁钉中铁元素的质量分数为______;
(6)利用“活泼金属”可以制得 H2 用作汽车能源。若推广应用于汽车产业,则需综合考虑的因素有________ (填字母序号)。
A 金属原料的成本 B 生成过程中的能耗和污染 C 金属的回收利用
查看答案和解析>>
科目: 来源: 题型:
【题目】目前,废旧电池对环境的污染已越来越引起人们的重视。为了实现可持续发展的战略目标,许多有识之士正在研究废旧电池的有效回收再利用技术。如图为普通电池(锌锰电池)示意图,请你根据图示分析回答:

(1)废旧电池内含有的一种有机物名称是_____;
(2)小李同学想得到⑤中纯净干燥的二氧化锰和氯化铵溶液,并检验氯化铵中的铵根离子,设计了如下实验(如下图所示),请回答

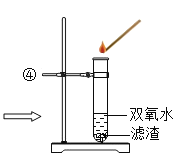
实验①:玻璃棒的作用是_____;
实验②:过滤后,滤液仍然浑浊,则造成浑浊的原因可能_____(填一种);
实验③:灼烧的目的是_____;实验④中 MnO2 的作用是_______。
(3) 氯化铵中铵根的离子检验方法:用小试管取少量滤液,滴加氢氧化钠溶液,微热,将_____试纸放在试管口,如果变蓝,则证明滤液中含有铵根离子。反应方程式为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com