
科目: 来源: 题型:
【题目】实验是进行科学探究的主要方法。下图是初中化学常见实验装置。请回答:

(1)装置中仪器①的名称为_____。
(2)若选用A装置来制取氧气,则反应的化学方程式为_____。
(3)①实验室常用大理石和稀盐酸反应制取CO2,反应的化学方程式为_____。制取并收集CO2可选用的装置组合是_____(填字母)。
②若用E装置干燥并收集一瓶某气体,则该气体可能是_____(填字母)。
A CO2
B O2
C H2
D NH3
(4)实验室可用块状电石(CaC2) 与足量的水在常温下剧烈反应制取乙炔(C2H2)气体,该反应的化学方程式是_____。图中适合制取乙炔气体的发生装置是_____(填字母)。
(5)小雨同学在探究Al、Fe、Cu三种金属的活动性实验时,设计了如下方案:
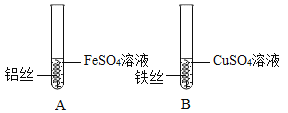
①小雨在很长时间内都未观察到A试管中预期的实验现象,从操作上分析可能的原因是_____。
②实验成功后,小雨把两支试管中所有物质合并,然后倒入烧杯中,充分反应后,烧杯中仍有不溶性固体。为此,小雨继续展开探究。
[提出问题]不溶性固体中含有哪些成分?
[实验并得出结论]过滤,向滤出的不溶性固体中滴加足量的稀硫酸,有气泡冒出,则该不溶性固体中一定含有的物质是_____,此时一定发生反应的化学方程式是_____。
③[反思与评价]小军同学用表面积相等的以上三种金属片分别与等浓度等体积的稀盐酸反应完成同样的探究,却意外发现铁片中加稀盐酸后,溶液变为黄色。试写出溶液变为黄色的化学方程式_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】NiSO46H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu、Zn、Fe等杂质)为原料获得。有关工艺流程如图:
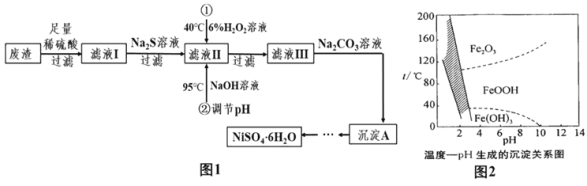
(相关资料)①Ni能与稀硫酸反应生成NiSO4和H2
②ZnSO4+Na2S=ZnS↓+Na2SO4
③H2O2溶液能将FeSO4氧化成Fe2(SO4)3
④NiCO3是一种不溶于水、易溶于强酸的浅绿色沉淀。
(问题解答)
(1)向废渣中加入足量稀硫酸的目的是_____。
(2)在滤液Ⅱ中加入H2O2溶液时,温度不能太高的原因是_____。
(3)除铁时还能加入适量的Na2CO3溶液调节酸度,反应生成Na2SO4、CO2气体和一种浅黄色的黄铁矾钠沉淀[化学式为:Na2Fe6(SO4)4(OH)12],这样可以将Fe3+除去。写出该反应的化学方程式_____。如图是温度—pH与生成的沉淀关系图,图中阴影部分是黄铁矾钠稳定存在的区域。下列说法正确的是_____(填序号)。
A FeOOH中铁元素为+2价
B Fe2O3固体为红色
C 若在25℃时,用H2O2氧化Fe2+,再在pH=4时除去铁,此时溶液中出现的沉淀是FeOOH和Fe(OH)3
D 工业生产中常保持在85~95℃生成黄铁矾钠,此时水体的pH为1.5左右
(4)从“沉淀A”制得NiSO46H2O晶体的实验步骤依次为:向沉淀中加入_____溶液,直至恰好完全溶解,转化为NiSO4溶液;蒸发浓缩、冷却结晶,过滤得NiSO46H2O晶体,用少量乙醇洗涤NiSO46H2O晶体并晾干。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学源于生活又服务于生活:
(1)请用化学知识解释下列问题
①医疗急救时需要用______,是因为其能供给呼吸;
②食物保存在冰箱中不易变质,是因为化学反应速率与________有关;
③铁元素是人体必需的一种微量元素。食用“加铁酱油”可预防___________;
④制作馒头面包用的发酵粉的主要成分是_______,其能与有机酸反应生成气体。
(2)小明一家与朋友们决定使用“共享汽车”出行。
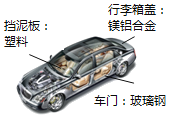
①“共享汽车”中的挡泥板所用材料属于_____________材料,②将镁铝合金与铝片相互刻画,在铝片表面留下明显划痕,说明镁铝合金的硬度_____ 铝的硬度(填“大于”或“小于”)。③为减少空气污染,部分“共享汽车”已改用压缩天然气为燃料,其主要成分为__________(填化学式)。
④使用“共享汽车”出行的好处有______(填标号)
a降低出行成本 b减少汽车尾气排放
c节约能源 d降低交通压力
查看答案和解析>>
科目: 来源: 题型:
【题目】A~H是初中常见的物质,已知A~G七种物质均含有同一种元素, D的相对分子质量为100,可用作建筑材料。它们之间的转化关系如图所示,图中“一”表示两端物质间能发生化学反应,“→”表示物质间存在转化关系;反应条件、部分反应物和生成物已略去。下列说法中不正确的是
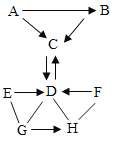
A.A为一种单质,D为碳酸钙
B.可能涉及四种基本反应类型
C.E、F的物质类别可能相同,也可能不同
D.H的浓溶液具有挥发性
查看答案和解析>>
科目: 来源: 题型:
【题目】NaCl是重要的资源,其应用与生产如下图所示。下列说法不正确的是
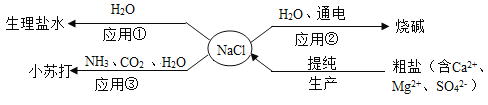
A.应用①操作的主要步骤为:计算、称量、溶解、装瓶、贴标签
B.应用②在制备烧碱的过程中,水参与了反应
C.应用③为提高产率应先通NH3,再通CO2,制备过程中还能得到一种化肥
D.生产中提纯粗盐时可依次加入过量的BaCl2、NaOH、Na2CO3溶液,再过滤、蒸发
查看答案和解析>>
科目: 来源: 题型:
【题目】如图能正确反映其对应操作中各物质量的变化关系的是
A. 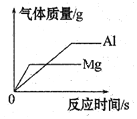 分别向等质量、等质量分数的稀硫酸中加入足量的镁、铝
分别向等质量、等质量分数的稀硫酸中加入足量的镁、铝
B. 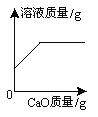 向饱和Ca(OH)2溶液中不断地加入CaO固体粉末
向饱和Ca(OH)2溶液中不断地加入CaO固体粉末
C. 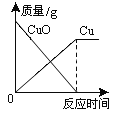 高温加热碳和氧化铜的混合物
高温加热碳和氧化铜的混合物
D. 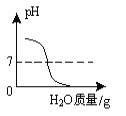 氢氧化钠溶液中加足量的水稀释
氢氧化钠溶液中加足量的水稀释
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是甲、乙固体的溶解度曲线。下列说法正确的是( )
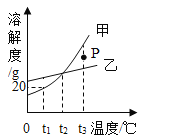
A.图中P点所表示的溶液是t3℃时甲的饱和溶液
B.可用t1℃时20%的甲溶液配制10%的甲溶液
C.若甲中含有少量乙,可采用冷却热饱和溶液的方法提纯甲
D.分别将t3℃等质量的甲、乙饱和溶液降温至t2℃,所得溶液中溶质质量相等
查看答案和解析>>
科目: 来源: 题型:
【题目】某工厂欲测定铝土矿中A12O3的含量,将矿石粉碎(其中杂质既不溶于水也不与酸反应),进行如下实验:
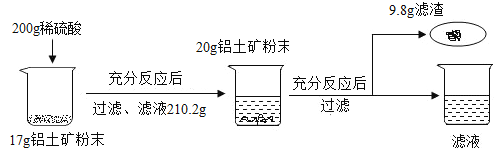
请回答下列问题:
(1)上述实验过程中发生反应的化学方程式为_____;
(2)铝土矿中A12O3的质量分数为_____;
(3)根据已知条件列出求解200g稀盐酸中溶质质量(X)的比例式_____;
(4)若将最终所得溶液蒸发掉20.4g水,所得不饱和溶液中溶质的质量分数为_____;
(5)用浓盐酸配置上述稀盐酸,需要的仪器有:烧杯、量筒、胶头滴管和_____;
(6)该炼铝厂每天用上述铝土矿170t来生产铝合金,则理论上日产含镁46%的铝镁合金的质量为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学课上,同学们利用下列分组实验来探究碱的化学性质:
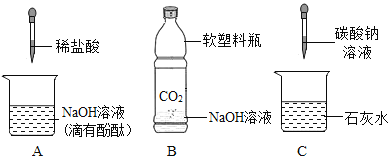
(1)做B组实验的同学看到了明显的现象是_____。
(2)实验结束,同学们将废液(废渣除外)倒入同一只废液缸中,最后发现废液呈无色。
[提出问题]废液中含有什么物质?
[猜想与假设]通过分析上述实验,同学们猜想:废液中一定含有_____。废液中的溶质(忽略酚酞)的成分引发了同学们的热烈讨论,下面是两位同学的发言:
小龙:氯化钠
小江:氯化钠、氯化氢
还可能是_____或_____;
[实验验证]小美同学对可能含有的溶质进行确定,取一定量的废液,向其中滴加几滴碳酸钠溶液,只看到_____的现象,小美确定小江猜想正确;
[反思与评价]小美同学由实验得出的结论_____(填写“正确”或“不正确”)。
[结论与应用]在得知小江同学猜想错误后,老师要求同学们从废液中回收氯化钠固体(利用已有的一种化学药品),你的具体操作方法是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com