
科目: 来源: 题型:
【题目】下列图像能正确反映对应的变化关系的是
|
|
|
|
A.常温下,向一定量的水中加入硝酸钾晶体 | B.硝酸铵溶于水时溶液的温度变化 | C.向稀盐酸和氯化钡的混合溶液中加入碳酸钠溶液 | D.CO 和过量的氧气在密闭容器中完全反应 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】兴趣小组的同学对金属的某些性质进行相关探究。
(实验回顾)
(1)如图所示,将两块金属片进行相互刻划。该实验的目的是_____。
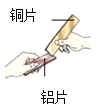
(2)用坩埚钳夹住一块铝箔在酒精灯上加热至较高温度时,轻轻摇晃,发现熔化的铝不滴落,好像有一层膜兜着(资料:铝的熔点660℃,氧化铝的熔点2054℃。)。请解释原因_____。
(实验探究)铝与氯化铜溶液的反应

将打磨过的铝片放在15%氯化铜溶液中,观察到铝片表面逸出大量无色气体,且附着红色物质,过一段时间还有白色沉淀产生。利用温度传感器和pH传感器监测实验过程中的相关数据(如图所示)。
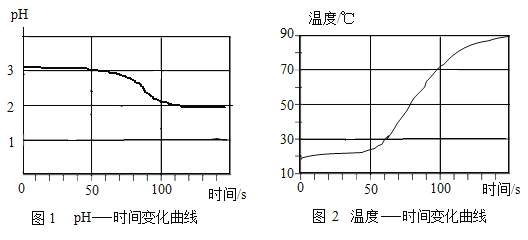
(实验反思)
(1)写出生成红色物质的化学方程式为_____。
(2)结合图1分析,铝和氯化铜溶液反应生成的无色气体是_____(填名称)。
(提出问题)白色沉淀的化学成分是什么?
(查阅资料)
①氢氧化铝、氯化亚铜(CuCl)均是难溶于水的白色固体。
②CuCl可与浓氨水反应生成无色的Cu(NH3)2+和Cl—。
③Cu(NH3)2+在空气中易被氧化变为蓝色;Cl—可与硝酸银溶液反应,产生白色沉淀。
(实验方案)将上述实验中产生的沉淀过滤出来,并洗涤干净后,加入浓氨水,沉淀部分溶解得到无色溶液,将无色溶液分为两份,进行实验。
操作步骤 | 实验现象 | 实验结论 |
用试管取其中一份溶液,滴加适量AgNO3溶液 | _____ | 该溶液中含有Cl— |
将另一份溶液置于空气中一段时间 | _____ | 该溶液中含有Cu(NH3)2+ |
(实验结论)通过实验可以确定,该白色固体是CuCl。
(反思与评价)
(1)小组同学将Cu粉与15%CuCl2溶液混合,没有观察到白色沉淀。在老师的启发下,结合图2“温度-时间变化曲线”,对实验进行改进,确证了Cu与CuCl2溶液反应生成CuCl。请你写出改进后的实验方案是_____。
(2)经过讨论CuCl是Cu与CuCl2化合反应生成。
(思维拓展)
(1)金属锌、铜和稀硫酸构成化学电池(如图)。观察到铜片表面有气泡(H2),小电珠发光、烧杯中溶液始终无色。下列关于实验的分析不正确的是_____(填序号)。
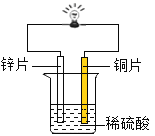
A 铜与稀硫酸发生了置换反应
B 铜的金属活动性变得比锌强
C 烧杯中溶液的pH会逐渐增大
D 该装置将电能转化为化学能
(2)某工厂化验室用20%NaOH溶液来中和上图实验前烧杯中的H2SO4,共消耗NaOH溶液20g,反应后的溶液呈中性,则上图烧杯中原来所含H2SO4的质量为_____(写出计算过程)。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列实验装置图,回答有关问题,
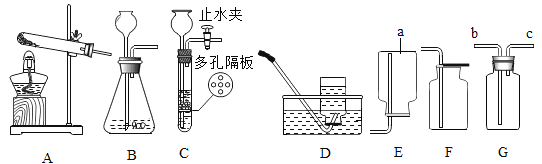
(1)装置图中仪器a的名称为_____。
(2)用氯酸钾和二氧化锰混合制取氧气,可选用的发生装置是_____(填字母),写出该反应的化学方程式_____;若用D装置收集氧气,当导管口气泡_____冒出时,再把导管口伸入盛满水的集气瓶。
(3)实验室用B装置制取二氧化碳的化学方程式为_____,如果用G装置收集气体,气体应从_____(填“b”或“c”)端通入;用C装置代替B装置,收集所需的气体量后,对C装置进行的操作是_____。
(4)氮的氧化物(NO2)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NO2还原成N2,某同学在实验室中对NH3与NO2的反应进行了探究。
(资料:NO2有毒,常温下为红棕色,实验中常用氢氧化钠溶液进行尾气处理;同温同压下,不同气体的体积之比等于分子个数之比。)
现将收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按下图装置进行实验。
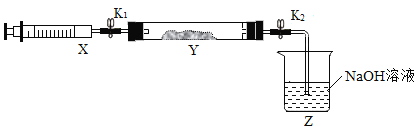
(Ⅰ)打开K1,推动注射器活塞,使X中的气体缓慢通入Y中,Y管中的现象_____,反应方程式是_____。
(Ⅱ)将注射器活塞退回原处并固定,待装置恢复到室温,Y中有少量水珠。
(Ⅲ)打开K2,观察到的现象_____,原因是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用制磷肥的副产物氟硅酸钠(Na2SiF6)生产冰晶石(Na3AlF6)的工艺流程 如图1,

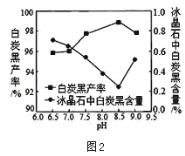
(1)分解过程发生的反应为:Na2SiF6+4NH3H2O=2NaF+4NH4F+X↓+2H2O。工业上把滤 渣X叫白炭黑,可用于纺织、造纸、食品添加剂领域,其化学式为_____。
(2)分解时白炭黑产率和冰晶石纯度与 pH 的关系如图 2, 分解时需要控制溶液的 pH=_____最为合适; 能提高其分解速率的措施有_________。(填字母)
A 快速搅拌 B 加热混合液至 100℃ C 增大氨水浓度
(3)写出水浴加热过程中生成冰晶石的化学方程式为_____。
(4)流程中可循环利用的物质是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】能源的利用与社会可持续发展密切相关。
(1)煤燃烧时产生NO2、_____等气体,这些气体或气体在空气中发生反应后的生成物溶于雨水,会形成酸雨。
(2)“低碳”是一种生活理念,也是一种生活态度。下列做法中不符合“低碳”要求的是_____
A 节约纸张
B 大量使用化石燃料
C 提倡使用节约技术和节能产品
D 尽量乘坐公交车
(3)在高温下,工业上以赤铁矿(主要成分是Fe2O3)和一氧化碳反应来炼铁的化学方程式为_____。
(4)在一定条件下,甲烷(CH4)和水反应(未配平)的微观示意图如图所示。

该反应中两种生成物Z和W的分子个数比为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】在密闭容器中有甲、乙、丙、丁四种物质、在一定条件下反应,测得反应前及反应过程中的两个时刻各物质的质量分数如下图所示。图中a、b、c、d分别表示相应物质的质量分数。下列数据正确的是
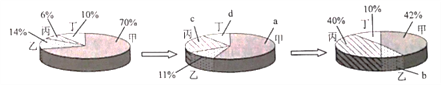
A. a=56% B. b=6% C. c=17% D. d=8%
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学利用图1装置研究稀盐酸与氢氧化钠溶液反应的过程,并用pH传感器和温度传感器测量反应过程中相关物理量的变化情况,得到图2和图3。下列说法错误的是
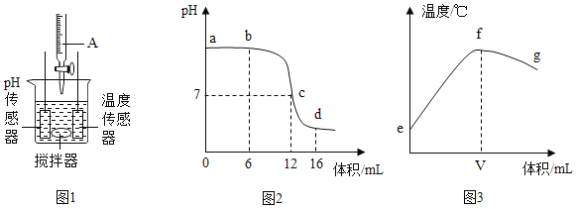
A.图2中b点所示溶液中的溶质是NaCl和NaOH
B.将图2中d点所示溶液加热蒸干所得固体为纯净物
C.图2中c→d所示溶液中NaCl的质量不断增加
D.图3中e→f变化趋势可说明该反应是放热反应
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是a、b、c三种物质的溶解度曲线,下列说法正确的是

A. P点表示t1℃时,a、c饱和溶液中溶质质量相等
B. t2℃时,将30ga物质加入到50g水中充分搅拌,得到80ga的饱和溶液
C. t2℃时等质量的三种饱和溶液降温至t1℃,所得溶液中溶剂质量c>b>a
D. 将t1℃时a、b、c三种物质的溶液分别升温至t2℃,其溶质质量分数都不可能发生变化
查看答案和解析>>
科目: 来源: 题型:
【题目】铟是制造触屏的重要材料,相关信息如图,下列说法中正确的是
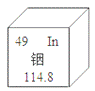
A.铟是一种非金属元素B.相对原子质量是114.8g
C.原子的核电荷数为49D.与其他元素根本区别是中子数不同
查看答案和解析>>
科目: 来源: 题型:
【题目】碳酸镁水合物是制备镁产品的中间体。
Ⅰ.(制取MgCO33H2O)工业上从弱碱性卤水(主要成分为MgCl2)中获取MgCO33H2O的方法如图1:
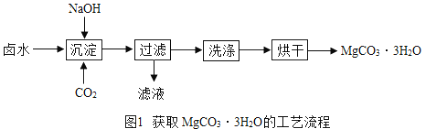
(1)沉淀过程得到了MgCO33H2O晶体和氯化钠的混合物,写出沉淀过程发生的化学反应方程式:________________________________________________。
(2)过滤需要用到的玻璃仪器有烧杯、玻璃棒和______,证明MgCO33H2O沉淀已洗涤干净的方法是,取最后一次洗涤液,_____________________________,说明已洗净。
(3)沉淀过程的溶液中镁离子含量随时间的变化如图3所示,不同温度下所得到沉淀产物如下表所示。
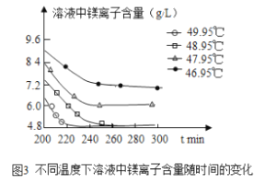
温度(℃) | 产物 |
46.95 | MgCO33H2O |
47.95 | MgCO33H2O |
48.95 | MgCO33H2O |
49.95 | Mg5(OH)2(CO3)44H2O |
则沉淀过程选择的温度为________,理由是此温度下,Mg2+沉淀的速率较快,沉淀效率较高,且不会生成其它沉淀。
Ⅱ.(测定MgCO33H2O的纯度)
(查阅资料)
a.碱石灰是CaO与NaOH的固体混合物。
b.MgCO33H2O+H2SO4=MgSO4+CO2↑+4H2O。
c.Mg5(OH)2(CO3)44H2O也可以表示为Mg(OH)24 MgCO34H2O,其相对分子质量为466,能与硫酸反应生成CO2。
(实验步骤)
利用如下图所示装置(图中夹持仪器略去)进行实验,以确定MgCO33H2O的纯度。
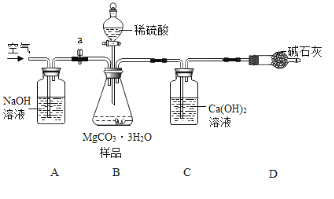

依据实验过程回答下列问题:
(1)实验结束后需持续缓缓通入空气,其作用为______________________________。
(2)C装置中反应生成CaCO3的化学方程式为_______________________;D中碱石灰的作用为_______________________________。
(3)下列各项措施中,能提高测定准确度的是_________(填标号)。
a在加入硫酸之前,应排净装置内的CO2气体
b为了缩短实验时间,快速滴加硫酸
c在B~C之间增添盛有浓硫酸的洗气装置
d在C装置左侧导管末端增添多孔球泡
e将C装置中澄清石灰水换成Ba(OH)2溶液
(4)实验中准确称取15.0g样品三份,进行三次测定,测得生成CaCO3沉淀的平均质量为10.0g。请计算样品中MgCO33H2O的纯度(写出计算过程)。______
(5)若获取MgCO33H2O的样品中含有少量Mg5(OH)2(O3)44H2O,则样品中MgCO33H2O的纯度___(填“偏大”“不变”或“偏小”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com