
科目: 来源: 题型:
【题目】如图所示,A-I是初中化学常见的物质,分别由C、H、O、S、Cl、Na、Ca、Fe中的一种或几种元素组成。A由一种元素组成,B、D、G、H、I均由两种元素组成,C、E、F均由三种元素组成。B中两种元素的质量比为7:3,I中两种元素的原子个数比为1:4,固态G俗称“干冰”。图中“-”表示两物质间能反应,“→”表示两物质间的转化关系;反应条件已略去。
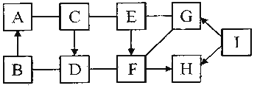
(1)写出化学式:B_____,I____。
(2)A与C反应的基本反应类型是_____。
(3)C→D的化学方程式为___。
(4)E→F的化学方程式为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】元素周期表是学习和研究化学的重要工具。溴元素的相关信息如图1所示,回答下列问题
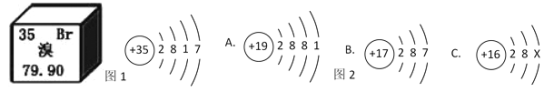
(1)溴的相对原子质量是__________。
(2)溴元素的化学性质与图2哪种元素的化学性质相似______________(填序号)。
(3)若图2中C表示原子的结构,则X=___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图为实验室制取氢气的发生装置.若液面刚好不与锌粒接触而又无酸液可加,要得到氢气, 可从长颈漏斗中加入的适量试剂是( )
①食盐水;②硫酸钠溶液;③氯化钡溶液;④碳酸钠溶液
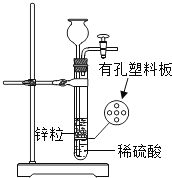
A.①②③B.①②④C.②③④D.①③④
查看答案和解析>>
科目: 来源: 题型:
【题目】材料一:1673年,玻义耳曾经做过一个实验:在密闭的曲颈瓶中加热金属时,得到了金属灰,冷却后打开容器,称量金属灰的质量,发现与原来金属相比质量增加了。
材料二:1703年,施塔尔提出“燃素学说”,其主要观点有:①燃素是组成物体的一种成分,一般条件下被禁锢在可燃物中;②燃素在可燃物燃烧时会分离出来,且燃素可穿透一切物质。
材料三:1756年,罗蒙诺索夫重做了玻义耳的实验。他将金属铅装入容器后密封、称量。然后把容器放到大火上加热,银白色的金属变成了灰黄色,待容器冷却后再次称量,发现容器的总质量没有发生变化。罗蒙诺索夫对此的解释是:“容器里原来有一定量的空气,且容器中的空气质量减少多少,金属灰的质量就比金属增加多少,在化学变化中物质的质量是守恒的。”后来,拉瓦锡等科学家经过大量的定量实验,推翻了“燃素学说”,质量守恒定律得到公认。
(1)由“燃素学说”可知,物质燃烧后质量应该减少。请根据所学知识写出一个可以推翻“燃素学说”的事实:__________________________________。
(2)罗蒙诺索夫重做了玻义耳的实验是基于金属加热后,增加的质量并非来自燃素而是来自________________的假设。
(3)对比材料一和材料三,玻义耳错过了发现质量守恒定律的一个重要原因是__________________________________。
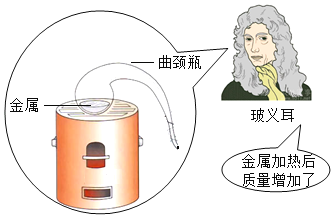
(4)质量守恒定律的发现过程,给我们的启示是________________。
A.分析问题应该全面、严谨
B.实验的成功与否,取决于药品的选择
C.定量方法是科学研究的重要方法
D.科学研究既要尊重事实,也要勇于创新
查看答案和解析>>
科目: 来源: 题型:
【题目】某兴趣小组欲测定铁矿石中氧化铁的含量,取一定量的矿石粉碎后,用下图方式进行实验,(注意:杂质既不溶于水也不与酸反应,实验过程中物质的损失忽略不计)
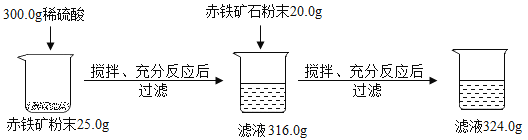
(1)求赤铁矿中氧化铁的质量分数是 。
(2)原300.0g稀硫酸中溶质的质量分数。(写出计算过程,结果保留0. 1%)
查看答案和解析>>
科目: 来源: 题型:
【题目】废水处理首先考虑“以废治废”的原则。现有冶金厂和造纸厂排放的废水,按照一定的流量比集中到污水处理池中进行综合处理,如下图所示。
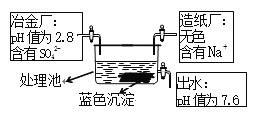
⑴造纸厂废水中一定含有的离子: Na+、_____(填离子符号,下同)。冶金厂废水中一定含有的离子: Cu2+ 、_______、 SO42-。
⑵写出废水处理池中除产生蓝色沉淀以外的另一个化学反应方程式______________。
⑶经测定冶金厂废水中还含有微量的镍离子。已知镁的活动性比镍的活动性强,硫酸镍NiSO4易溶于水。请写出可表示镁比镍活泼的化学方程式____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有A-H七种常见物质,其中B是食品包装中的常用的干燥剂,C是常见的建筑材料的主要成分,A、B、C三种白色固体都含有同种金属元素,D、F是组成元素相同的两种化合物,E是一种黑色固体单质,H主要用于制玻璃。它们的转化关系如图。请回答:
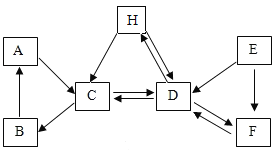
(1)写出下列物质的化学式:A_____________C______________E_____________
(2)写出下列变化的化学方程式:
C→B______________________;
D→F______________________;
A与H的反应:______________________;
(3)物质F的用途(写一条):______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】据图回答下列问题: (铁架台、 棉网等已省略,方程式2分)
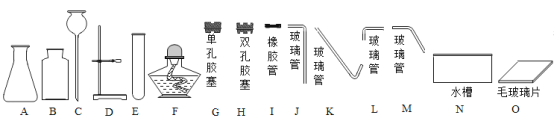
(1)仪器C的名称是_______________。
(2)组装一套用氯酸钾制取氧气并用排水法收集氧气的装置时,已经选用DEGMI仪器组件,还需要选用上图中的______________组件。(填字母序号,选全,缺漏不得分)
(3)选择气体的发生装置时,需要考虑反应物的状态和_______________。
(4)用甲图的装置,分离CO和CO2的混合物,分别得到较纯净的CO和CO2。其中所用的化学试剂可能为: I.饱和氢氧化钠溶液;
II.稀硫酸;
III.稀盐酸。

图甲中广口瓶内应装的药品是___________(填序号),分液漏斗中的药品是_____________(填序号)。
(5)实验时,混合气体应从甲装置导气管口__________端通入,从导气管口___________端逸出,逸出的气体是_____________(水蒸气除外),广口瓶里发生反应的化学方程式是:_______________。
(6)混合气体通入完毕后,再打开分液漏斗的开关阀门K,使漏斗中的药品流入广口瓶里,这时发生的反应是_______________,此时逸出的气体是_______________(水蒸气除外)。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是几种物质的溶解度曲线,请根据图示回答:
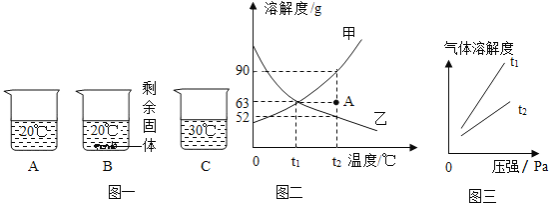
(1)向装有等量水的A、B、C烧杯中分别加入10g、25g、25g NaNO3固体, 充分溶解后,现象如图一所示。烧杯中的溶液一定属于饱和溶液的是____________(填序号);
(2)图二能表示NaNO3溶解度曲线的是_____________(填“甲”或“乙”);
(3)由图二分析,若分别将甲、乙的饱和溶液从t2°C降温到t1°C,对所得溶液的叙述正确的___________(填序号)。
A甲、乙都是饱和溶液
B所含溶剂质量:甲<乙
C溶液质量:甲<乙
D溶质质量分数:甲>乙
(4)如图二所示,现有一杯t2°C时A点的甲溶液,100g水中溶有63g甲,若将其变成饱和溶液,可以增加溶质甲_____________g,或者蒸发掉水____________g,或者还可以将温度_______________。
(5)由图二分析,下列说法正确的是_______________。
A将甲物质的不饱和溶液变为饱和溶液,其溶质的质量分数一定变大
B将t1°C时乙溶液升温到t2°C,其溶液的质量一定减小
C配制一定溶质质量分数的甲物质溶液,若量取水时俯视读数,其它操作均正确,则配制的甲溶液中溶质的质量分数将偏高
(6)某同学在实验室用固体甲和蒸馏水配制50g质量分数为6%的甲溶液时(固体甲全部溶解),涉及以下实验步骤:①溶解②称量和量取③计算④装入试剂瓶贴好标签,配制上述溶液正确的实验步骤顺序是_______(填序号)
(7)如图三所示,气体的溶解度也有一定规律,如:在t1°C和t2°C这两个不同温度下,氧气的溶解度随压强而变化的情况,若t1°C对应的温度为40°C,则t2°C对应的温度____________(填字母序号)
A小于40°C
B大于40°C
C等于40°C
D无法确定
查看答案和解析>>
科目: 来源: 题型:
【题目】建立宏观与微观之间的联系,是化学学科特有的思维方式。
(1)图中A、B、C、D是四种粒子的结构示意图,E是碘元素在元素周期表中的信息。回答下列问题:
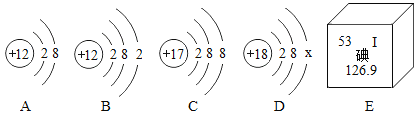
①A、B、C、D四种粒子共表示_______________种元素。
②构成氯化镁的微粒是________________(填字母序号)。
③E中碘元素原子的核内质子数为______________________。
(2)如图是某化学反应微观示意图。在点燃条件下,A和B反应生成C和D。
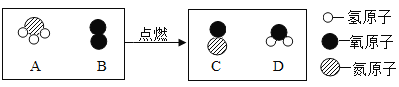
①1个A分子中含有__________个原子。
②A中氮元素和氢元素的质量比为____________________。
③A在B中充分燃烧的化学方程式为____________________。
④生成C与D的质量比是____________________。
(3)请你根据表中信息,类推出丙酸的化学式____________________。
物质名称 | 甲酸 | 乙酸 | 丙酸 | 丁酸 | 戊酸 |
化学式 | CH2O2 | C2H4O2 | ? | C4H8O2 | C5H10O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com