
科目: 来源: 题型:
【题目】如图是元素周期表中的一格,从中获取的信息不正确的是( )
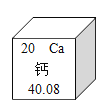
A.该元素属于金属元素B.该元素原子的核外有20个电子
C.该元素原子的质量为40.08gD.该元素原子的核内有20个质子
查看答案和解析>>
科目: 来源: 题型:
【题目】在点燃条件下,甲和乙反应生成丙和丁,反应前后分子变化的微观示意图如下,下列说法正确的是( )
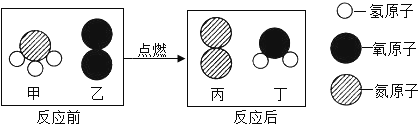
A.乙和丁都是氧化物
B.该反应是复分解反应
C.甲和乙反应的质量比为17:32
D.生成物丙和丁两种物质的分子个数比为1:3
查看答案和解析>>
科目: 来源: 题型:
【题目】氧化亚铜(Cu2O)用途广泛,实验室以CuSO4为原料制备Cu2O步骤如下:
预热:分别预热CuSO4溶液和Na2SO3溶液。
反应:在玻璃反应器中混合上述两种溶液,热水浴,搅拌,同时控制反应液pH。
处理:自然冷却后过滤,用蒸馏水洗涤4~5次,在80℃真空干燥箱中烘干,保存产品。
已知:Cu2O在潮湿空气中会逐渐氧化成CuO。
(1)反应原理为2CuSO4+3Na2SO3![]() Cu2O↓+3_+2SO2↑。实验时,热水浴加热的优点是___。
Cu2O↓+3_+2SO2↑。实验时,热水浴加热的优点是___。
(2)实验中,反应温度、反应液pH对产物中Cu2O%的影响分别如图所示:
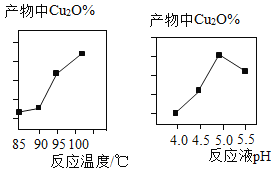
分析图像可知:最佳反应温度为____℃,该反应温度的优点有①____、②____。最佳反应液pH为_,若pH过低,产物中会有Cu杂质,则产物中Cu元素的质量分数将__(填“偏大”或“偏小”或“不变”)。
(3)产品洗净的标准是:取最后一次洗涤液,加入____(填试剂名称)溶液,若无白色沉淀产生,则说明已经洗净。
(4)产品烘干及保存要避免和潮湿空气接触,原因是____(填化学方程式)。
(5)工业上用CuSO4·5H2O制备Cu2O,若得到14.40吨Cu2O和一定质量的CuO(假设生产过程中Cu元素无损失),其中Cu2O和CuO的质量比为12:1,计算需要CuSO4·5H2O多少吨?写出计算过程,精确到小数点后两位)____
查看答案和解析>>
科目: 来源: 题型:
【题目】利用兰炭尾气(含N2、H2、CO、CO2、CH4及其他杂质等)合成氨及碳酸氢铵等的流程图如下:
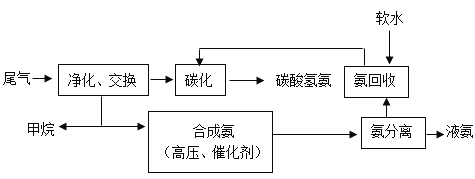
(1)2个氢分子的化学符号是____,标出CO2中C元素的化合价____(填化学用语)。尾气净化时,需要用活性炭除去气体杂质,这是利用了活性炭的____性。
(2)CH4燃烧时化学能转化为____能。甲烷燃烧的化学方程式为____。
(3)在一定条件下,N2、H2合成NH3,反应的化学方程式为____。理论上,12kg H2完全反应可生产____kgNH3。
(4)碳化产品碳酸氢铵的化学式为____。碳酸氢铵是____(填“氮肥”或“磷肥”或“钾肥”或“复合肥”),施用时,____(填“能”或“不能”)和碱性物质混用。
(5)生活中常用____鉴别硬水和软水。
查看答案和解析>>
科目: 来源: 题型:
【题目】SrCl2·6H2O具有很高的经济价值,以工业碳酸锶(SrCO3质量分数为98.5%,极少量Ba2+,微量Fe2+)为原料制备SrCl2·6H2O的工艺流程如下:
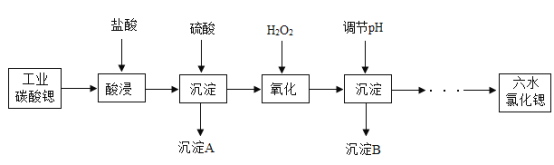
已知:
①SrCl2难溶于酒精,SrCl2·6H2O在61.5℃会失去结晶水,生成SrCl2·2H2O。
②降温结晶速率太快,会导致晶体细碎,夹带溶液,导致晶体不纯。
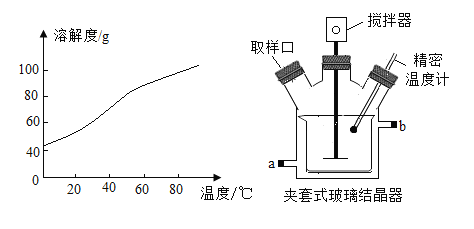
③SrCl2溶解度曲线及结晶装置图如下:
(1)酸浸时,搅拌的作用是____。发生反应的化学方程式主要为____,属于____反应(填基本反应类型)。能否用稀硫酸代替稀盐酸,__(填“能”或“否”)理由是___。
(2)沉淀A为____(填化学式),沉淀B为红褐色,是____(填化学式)。调节pH时,最好选用的试剂是____。
A NaOH
B Ca(OH)2
C Sr(OH)2
(3)流程中,“……”为一系列操作,分别为蒸发浓缩→____→过滤→洗涤→烘干。实验室完成过滤操作所需的玻璃仪器有烧杯、玻璃棒、____。夹套式玻璃结晶器的夹套内是冷却水,可由外接计算机程序精确控制进水的温度,进水口为____(填“a”或“b”)。
(4)洗涤SrCl2·6H2O晶体适宜选用的试剂是____。
A 0℃时蒸馏水
B 常温SrCl2饱和溶液
C 热水
D 无水酒精
(5)SrCl2·6H2O晶体烘干的适宜温度为___。
A 50 ~ 60℃
B 70 ~ 80℃
C 80 ~ 100℃
D 100℃以上
(6)常用锶转化率衡量工艺水准,本工艺使用100吨工业碳酸锶,最终得到176.9吨SrCl2·6H2O,则本工艺中的锶转化率约为___。(精确到小数点后一位)
查看答案和解析>>
科目: 来源: 题型:
【题目】绿矾(FeSO4·7H2O)是一种翠绿色晶体,高温会分解,生成一种金属氧化物M和三种非金属氧化物。某小组利用下图装置检验绿矾分解的部分产物并对尾气进行处理。
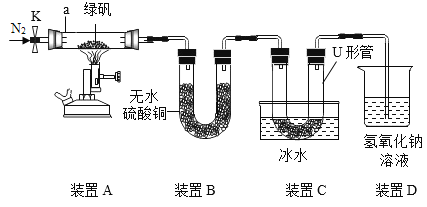
已知:
①1个大气压下,0℃时,SO3为固态。②无水硫酸铜遇水由白色变为蓝色。
(实验步骤):
将一定量绿矾固体置于仪器a中,打开止水夹K,通入一段时间N2,关闭止水夹K。加热装置A中的仪器a一段时间,待装置A中固体不再分解后,停止加热,_____,缓慢通入N2至仪器a冷却。
(1)写出仪器a 的名称____。
(2)完善实验步骤中的内容:____。实验中先通一段时间N2的目的是___。
(3)装置A中绿矾完全反应的现象是____。
(4)已知M中铁元素的质量分数为70%,M的化学式为___。
(5)装置B中固体部分变蓝色,说明绿矾分解后,生成____。装置D的作用是____。
(6)取U形管内物质少量,加入水中,滴入____(填试剂名称),溶液呈红色,是因为反应生成了一种常见的酸,该反应的化学方程式为____。
查看答案和解析>>
科目: 来源: 题型:
【题目】NSR技术通过BaO和Ba(NO3)2的相互转化实现NOx(氮氧化物)的储存和还原。以NO为例,其工作原理如下图所示,下列说法正确的是
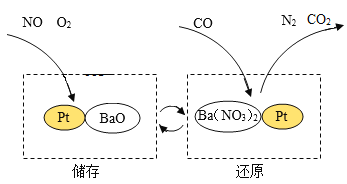
A.储存和还原过程中,只有N、O元素化合价发生改变
B.该技术可以降低NOx的排放
C.还原过程产物CO2中氧元素质量等于储存过程中NO和O2中氧元素质量之和
D.该技术需要不断增加BaO和Ba(NO3)2才能实现NOx的储存和还原
查看答案和解析>>
科目: 来源: 题型:
【题目】硒元素有防癌抗癌作用,硒原子的结构示意图及硒元素在周期表中的信息如下图所示,下列说法不正确的是
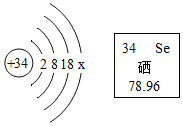
A.x 的数值是6
B.硒元素属于金属元素
C.硒原子中质子数为34
D.硒元素属于人体必需的微量元素
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组向12g石灰石样品中不断加入稀盐酸至不再产生气体,反应过程中产生气体与稀盐酸的质量关系如图所示。
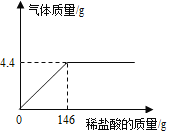
(样品中杂质不与酸反应,也不溶于水)请回答下列问题:
(1)反应产生二氧化碳气体的质量是_____g
(2)计算所用稀盐酸的溶质的质量分数。_____(写出计算过程)
(3)上述实验恰好完全反应时所得溶液的质量为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】生铁用途十分广泛。工业上利用赤铁矿(主要成分是 Fe2O3,还含少量 SiO2 等杂质)冶炼生铁的过程如下:

回答下列问题:
(1)生铁属于_____材料(填“合成”或“金属”)。“高炉气体”中的_____(填化学式)会导致酸雨。
(2)“煅烧”时:
①生成 CO 的反应之一为 C + CO2 ![]() 2CO,该反应属于_____反应(填基本反应类型)。
2CO,该反应属于_____反应(填基本反应类型)。
②用化学方程式表示利用 CO 炼铁的原理_____。
③CaCO3 和 SiO2 固体在高温条件下发生反应,生成 CO2 气体和 CaSiO3,该反应的化学方程式为_____。
(3)生活中铁制品锈蚀的过程,实际上是 Fe 与空气中_____、_____等发生化学反应的过程。下列措施能防止铁制品锈蚀的是_____(填标号)。
A 涂油、喷漆 B 镀耐腐蚀的铬层
C 用盐水清洗 D .久置于酸性环境
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com