
科目: 来源: 题型:
【题目】金属及其制品是现代生活中不可缺少的材料和工具。
(1)汽车电路中的导线大都是铜制的,这是利用了金属铜的延展性和_______性
(2)铝制品一般无需做防锈处理,原因是铝在空气中生成了________(填化学式)
(3)某同学将铁刀放入一种溶液中,结果“铁刀变铜刀”,其可能的反应的方程式为______
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图象分别与选项中的实验现象及结果相对应,其中正确的是( )

电解水

B.将等质量的镁和铁分别投入到盛有足量同种稀硫酸的两个容器中

C.等体积、等溶质质量分数的过氧化氢溶液制取氧气

D.服用胃舒平[主要成分是Al(OH)3] 治疗胃酸过多,胃液pH的变化
查看答案和解析>>
科目: 来源: 题型:
【题目】下图表示的是甲、乙两种固体物质的溶解度曲线,下列叙述正确的是
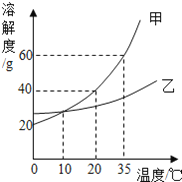
A.甲的溶解度大于乙的溶解度
B.35℃时100g甲的溶液中含甲的质量60g
C.降低温度可使接近饱和的甲溶液变成饱和溶液
D.10℃时甲、乙两种溶液的溶质质量分数一定相等
查看答案和解析>>
科目: 来源: 题型:
【题目】氯酸钾在工业上用于制造焰火、漂白剂等,在实验室可用于制造氧气。工业上利用石灰浆制备氯酸钾的流程是:

(1)写出实验室用氯酸钾制取氧气的化学方程式____________________。
(2)在实验室里,“操作a”中需要用到玻璃棒,其作用是__________。
(3)“反应1”的化学反应方程式为:6Ca(OH)2+6Cl2=Ca(ClO3)2+5CaCl2+6X,Ca(ClO3)2的名称是__________,X的化学式为__________。
(4)下表是有关物质常温下的溶解度。
物质 | KCl | CaCl2 | KClO3 | Ca(ClO3)2 |
溶解度/g | 34.2 | 74.5 | 7.3 | 209.0 |
“反应2”为复分解反应,参看表中溶解度,写出该反应的化学方程式__________。
(5)上述石灰浆可由电石(CaC2)与水反应制得。现有某电石渣,其中含氢氧化钙92.5%,用该电石渣处理含硫酸49Kg的酸性废水(假设电石渣中的杂质、废水中其他成分均不参加反应),需要电石渣的质量是__________kg。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列为实验室常用的实验装置示意图。请回答:
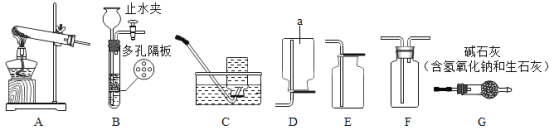
(1)仪器a的名称是__________。
(2)实验室用高锰酸钾制氧气的化学方程式为__________,可选用的发生装置和收集装置的组合是_________;若用F装置除去氧气中的水蒸气,F中盛放的液体试剂是__________。
(3)可用G装置干燥的气体是__________(举出一例)。
(4)用D装置可收集CH4、NH4、SO2、Cl2等气体中的__________。
(5)B装置可作为制取__________气体的发生装置,其优点是能控制反应的发生或停止,使该装置中的反应停止的原理是______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】亚硝酸钠(NaNO2)外形与食盐相似,人若误食会引起中毒。NaNO2、NaCl的溶解度曲线如图所示。请回答:
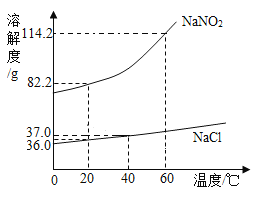
(1)20℃时,向90gNaNO2固体中加入100g水,充分溶解后,所得溶液质量为__________g。
(2)20℃时,将182.2gNaNO2饱和溶液蒸发掉50g水,再降温到20℃,可析出晶体的质量为________g。
(3)除去NaNO2固体中混有的少量NaCl,实验步骤是:加水溶解,蒸发浓缩,__________,然后过滤、洗涤、干燥。
(4)以下是鉴别NaNO2、NaCl固体的方案:20℃时,取6gNaNO2和6gNaCl分别放入两只小烧杯中,各加入10mL水(水的密度为1g/mL),用玻璃棒充分搅拌后,观察现象。你认为此方案是否可行?________(填“可行”或“不可行”)。
(5)某温度下,饱和氯化钠溶液的溶质质量分数为26%,该温度下氯化钠的溶解度是__________g(结果精确到0.1g)。
查看答案和解析>>
科目: 来源: 题型:
【题目】向盛有少量硝酸镁溶液的烧杯中滴加氢氧化钾溶液至恰好反应。请回答:
(1)上述反应中的实验现象为____________________。
(2)如图表示该反应前后溶液中存在的主要离子,写出每种图形代表的离子(填离子符号)。
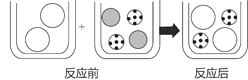
![]() ______;
______;![]() ______;
______;![]() ____。
____。
(3)在硝酸镁溶液中滴加__________溶液,也会出现上述实验中相同的实验现象,从微观角度分析,产生该现象的原因是______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】人类的日常生活、工农业生产、教学科研都离不开水。
(1)净化水的常用方法有:沉淀、过滤、吸附和__________。
(2)日常生活中,降低水的硬度的方法是__________。
(3)自来水厂净水过程中,可用硫酸铝作絮凝剂,制取硫酸铝的化学方程式为__________。
(4)根据下图所示装置回答。
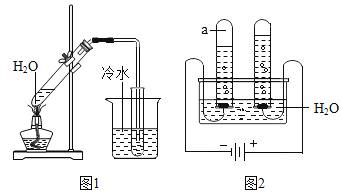
①图2装置的试管a中的气体是__________。
②图1和图2装置所示实验,从分子和原子的观点来看,水所发生变化的本质区别是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】金属材料在生产、生活中应用广泛。
(1)铝块能被加工成很薄的铝箔,是利用了铝的__________性。
(2)钢铁是使用最多的金属材料,钢的硬度比纯铁的硬度__________(填“大”或“小”)。
(3)自行车的支架是铁制品,为防止锈蚀,在其表面刷漆,其防锈原理是__________。
(4)用一定量AgNO4溶液进行下图所示实验。

①在固体A上滴加稀盐酸,没有气泡产生,则固体A的组成是__________。
②溶液B呈蓝色,溶液B中一定含有的金属阳离子是__________(写离子符号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】很多饮料都含有柠檬酸(C6H8O7)。下列关于柠檬酸的说法中正确的是( )
A.属于氧化物
B.柠檬酸中碳、氢、氧三种元素的质量比为9:1:14
C.19.2g柠檬酸中碳元素的质量是1.2g
D.柠檬酸中所含氢元素的质量分数为![]() ×100%
×100%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com