
科目: 来源: 题型:
【题目】某化学兴趣小组同学将铜丝绕成螺旋状后,在酒精灯火焰上加热,铜丝变黑后,趁热插入疏松的氯化铵(NH4Cl)固体里,变黑的铜丝又变回紫红色。他们对此产生了兴趣,于是在老师的指导下进行如下探究:
(查阅资料)(1)氯化铵受热易分解,反应的化学方程式为:NH4Cl![]() NH3↑+HCl↑;
NH3↑+HCl↑;
(2)NH3+HCl=NH4Cl;
(3)无水硫酸铜为白色固体,遇水会变成蓝色。
(提出问题)使氧化铜还原为铜的是什么物质?
(作出猜想)猜想一:CO 猜想二:HCl 猜想三:NH3
小晶认为猜想一不合理,理由是_________。
(实验探究)兴趣小组同学按如下装置进行实验(夹持装置已省略):
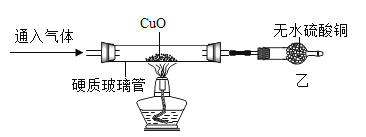
实验操作 | 实验现象 | 实验结论 |
将氯化氢气体和氨气分别通入装置,点燃酒精灯加热 | 通入氯化氢气体硬质玻璃管中无明显变化,通入氨气硬质玻璃管中观察到的现象是____。 | 猜想三成立 |
(反思与评价)
(1)通入氨气,观察到乙中固体变蓝,同时生成一种化学性质不活泼的气体。则氨气还原氧化铜的化学方程式为______。氨气有强烈的刺激性气味,对人体有害,则该装置存在的不足之处是________。
(2)小明认为实验室可用加热氯化铵的方法制取氨气,你认为该方法是否合理_________(填“合理”或“不合理”)。
(拓展延伸)“焊药”中含有氯化铵(NH4Cl),“焊药”的主要作用是清除焊接处金属表面生成的金属氧化物,确保焊接牢固。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E是初中化学中常见的物质,其中E是六大基本营养素之一。它们之间转化关系如图所示:
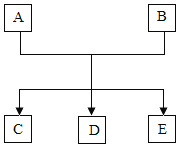
(1)若A是酸,C是食盐的主要成分,反应的化学方程式为__________。
(2)若在加热条件下,单质A能与B的浓溶液发生反应,且C溶液为蓝色,D会形成酸雨,D中组成元素的质量比为1∶1,则D的化学式为________。
(3)若A是碱,D是具有刺激性气味的气体,反应的化学方程式为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列实验室制取气体的装置图,回答有关问题:
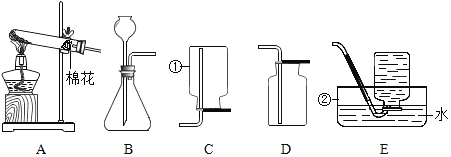
(1)写出仪器的名称:①_________②_________。
(2)实验室用高锰酸钾制取氧气,反应的化学方程式为________ 。若要收集干燥的氧气,选用的收集装置为________(填序号)。
(3)实验室制取二氧化碳选用的发生装置为_____(填序号),反应的化学方程式为________。
(4)实验室用亚硫酸钠固体与浓硫酸混合制取二氧化硫,二氧化硫密度比空气大且能溶于水。选用的发生装置为_________(填序号,下同),收集装置为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】人类社会发展离不开金属材料,结合所学知识,回答下列问题:
(1)生活中使用的金属材料大多是合金,而不是纯金属,这是因为合金具有更多优良性能。下列属于合金的是_________(填序号)。
a 黄铜 b 铝 c 生铁
(2)铁是化学性质比较活泼的金属,它在自然界主要以_____(填“单质”或“化合物”)的形式存在,为了防止铁栏杆生锈可采取的措施是__________。铝比铁具有更好的抗腐蚀性的原因___________。
(3)某学习小组在学习金属的化学性质时,进行如下实验:
实验操作 |
|
|
实验现象 | 金属表面产生气泡 | 金属表面无明显现象 |
由实验可知,两种金属的活动性顺序是A__________B(填“>”或“<”),若金属A为铁,则反应的化学方程式为_______。
(4)将一定量的铝粉投入硝酸铜、硝酸锌、硝酸银的混合溶液中充分反应后过滤,得到滤液和滤渣。下列说法正确的是__________(填序号)。
A 若滤渣中有3种金属,则滤液中可能有3种金属离子
B 若滤液为蓝色,则滤渣的组成有2种情况
C 取少量滤渣,加入足量的稀盐酸,产生气泡,则滤液中一定没有锌离子
D 取少量滤液,加入适量的氯化钠溶液,产生白色沉淀,则滤渣中一定没有银
查看答案和解析>>
科目: 来源: 题型:
【题目】城市中的生活用水是经自来水厂净化处理过的,下图为自来水厂净水过程示意图。请结合你所学的知识回答下列问题:
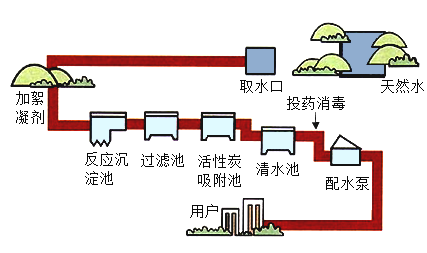
(1)天然水中的不溶性杂质(如泥沙),可通过过滤池除去,实验室中过滤操作需要用到的玻璃仪器有烧杯、漏斗、玻璃棒,其中玻璃棒的作用是__________;若过滤后所得滤液仍浑浊,可能的原因是______(填一种即可)。
(2)吸附池中可加入___________除去天然水中的臭味。
(3)消毒池中可加入臭氧(O3)进行消毒,水样中臭氧的浓度可用“碘量法”测定,原理是2KI+O3+ X=2KOH + I2+ O2,其中X的化学式为__________。
(4)易生水垢的自来水是硬水,生活中可用__________检验硬水和软水,通过_____的方法来降低水的硬度。把自来水进一步净化为蒸馏水的实验方法是________(选填“吸附”“消毒”或“蒸馏”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是甲、乙、丙三种固体物质的溶解度曲线。下列说法正确的是
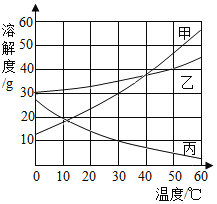
A.甲的溶解度大于乙
B.50℃时,将25g乙加入50g水中,可形成75g溶液
C.将50℃时甲的溶液降温至40℃,一定会析出晶体
D.将60℃的甲、乙、丙三种物质的饱和溶液降温至0℃,所得溶液中溶质质量分数由大到小的顺序为乙>甲>丙
查看答案和解析>>
科目: 来源: 题型:
【题目】某校化学兴趣小组欲探究 CO2 与 NaOH 溶液反应后的溶质组成。
(查阅资料)20℃时,几种物质在水中的溶解度(S):
物质 | Na2CO3 | NaHCO3 | Ca(OH)2 | Ba(OH)2 | NaOH |
S/g | 21.5 | 9.6 | 0.165 | 3.89 | 109 |
(实验探究Ⅰ)
实验一:取两只充满 CO2 的矿泉水瓶,分别加入50mL 的水和等体积的 NaOH 溶液,立即拧紧瓶盖, 实验如图,充分振荡。瓶子变瘪程度 A______B(填 “>”“=”“<”)。
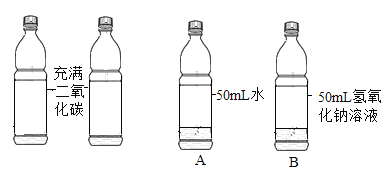
实验二:验证 B 瓶中反应生成了 Na2CO3:取少量 B 瓶中的溶液,滴加过量 BaCl2 的溶液,有白色沉淀生成,静置。
(1)该反应的化学方程式为______。
(2)实验中不宜将 BaCl2 溶液换成 CaCl2 溶液,原因是______。
实验三:取少量实验二中的上层清液,滴入几滴酚酞。
(3)溶液变红色。说明清液中还有 NaOH。
(4)实验二中必须加入过量的 BaCl2 溶液,理由是______。
(实验探究Ⅱ)
(查阅资料)
(1)本实验条件下,NaOH 溶液、Na2CO3 溶液和NaHCO3 溶液的 pH 分别约为 14.0、12.0和 8.5。
(2)将 CO2 通入少量的澄清石灰水中,溶液变浑浊,继续通 CO2 气体,浑浊逐渐消失, 其消失过程中发生的反应为:CaCO3 + H2O + CO2 =Ca(HCO3)2
(提出猜想)过量 CO2 与 NaOH 溶液反应后的溶质中还可能含有______(填化学式)。
(进行实验)小明在老师的帮助下利用数字传感器完成了以下实验。室温(约 20℃)下, 将 8gNaOH 溶于 190g 水中,然后向其中持续通入二氧化碳气体,同时用数字传感器测定溶液的 pH 变化,所得数据如图 2 所示。
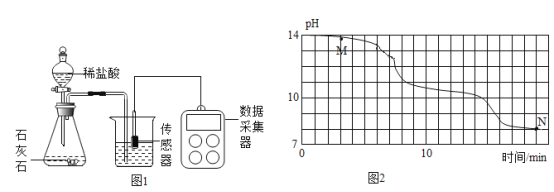
(得出结论)
(1)实验中,用“分液漏斗”而不用“长颈漏斗”的原因是______;
(2)根据资料和图像判断:M点溶质应为______(填化学式);
(反思交流)
(1)经多次重复实验,所得实验结果基本一致。实验过程中发现 18min 后溶液的 pH 基本不再变化,则此时烧杯内______(填“有”或“无”)晶体析出,原因是______。
(2)待 pH 不再变化后,取适量溶液,向其中滴加几滴稀盐酸,立即产生气泡,该反应的化学方程式为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】乙炔(C2H2)是有机合成中的重要原料。以电石(CaC2)为原料制取乙炔,并对电石渣综合处理的生产流程如图所示:
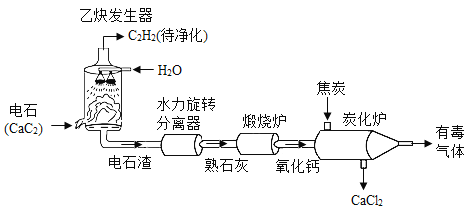
回答下列问题:
(1)乙炔发生器内发生反应的化学方程式为______。
(2)煅烧炉内氧化钙含量的变化有下图所示的结果,煅烧控制的最佳条件是______。

(3)碳化炉中,焦炭和氧化钙发生反应生成 CaC2 等,该反应中还原剂是______(写化学式),CaC2 中 C 元素化合价为______。碳化炉中的有毒气体不能直接排放,你对该有毒气体的处理建议是______。
(4)若将电石长期露置于空气中,会发生一系列变化,最终所得固体中一定含有的物质是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】图中 A~I 为初中化学常见物质,且分别由 H、O、Cl、S、Fe、Cu、Al 中的一种或几种元素组成。F 在空气中表面生成一层致密的氧化膜,具有很好的抗腐蚀性能; 只有 G 由三种元素组成:A、B、C、F、I均为单质;H、G 类别相同;图中“→”表示转化关系,“—”表示相互之间能发生反应(部分反应物、生成物及反应条件省略)。
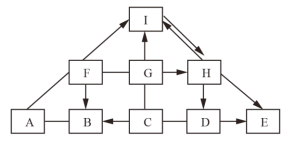
(1)写出 F 的化学式:______。
(2)写出 I→H 反应的化学方程式______。
(3)G 和 C 反应的基本反应类型为______。
(4)如 E 和F 含有同一种金属元素,写出 D→E 反应的化学方程式______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com