
科目: 来源: 题型:
【题目】化学与人类生活息息相关,联系学过的化学知识,按要求完成下列各题。
(1)牛奶是一种优质食品,除水外,牛奶中富含的营养素是______。
(2)煤燃烧时排放的气体中,会形成酸雨的气体是______(填下列序号):
A CO B CO2 C SO2 D NO2
(3)从能源能否循环再生的角度划分,煤、石油、天然气属于______(填“可再生”或“不可再生”)能源。
(4)“芯片”是智能化电器设备的核心,主要材料是高纯度的单质硅。制备高纯度硅其中一个反应是:SiO2+2C![]() Si+2CO↑,反应前后化合价设有发生改变的元素是______(填化学式)。
Si+2CO↑,反应前后化合价设有发生改变的元素是______(填化学式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】MgSO4饱和溶液的溶质质量分数随温度变化的曲线如图所示。下列说法正确的是( )
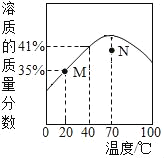
A. N点对应的MgSO4溶液升温或降温均都可能析出晶体
B. M点对应的MgSO4溶液是不饱和溶液
C. MgSO4饱和溶液的溶质质量分数随温度升高而增大
D. 40℃时,MgSO4的溶解度为41g
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室有一瓶久置的氢氧化钠固体,某同学想了解其变质情况,称取5g样品于烧杯中,加入30g水使之完全溶解,再向烧杯中缓缓加入14.37g的氢氧化钡溶液,恰好完全反应后,生成沉淀1.97g,求:
(1)样品中碳酸钠的质量分数;
(2)反应后所得溶液中氢氧化钠的质量分数.
查看答案和解析>>
科目: 来源: 题型:
【题目】通过晾晒海水或者煮盐井水、盐湖水等,可以蒸发除去水分,得到粗盐.粗盐中含有多种可溶性杂质(氯化镁、氯化钙等)和不溶性杂质(泥沙等).工业上以粗盐为原料制取精盐,其生产流程如图所示.请回答下列问题:
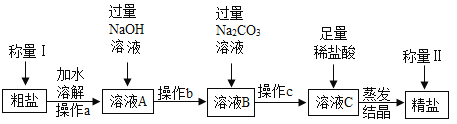
(1)已知操作a、b、c中均含同一种操作,其名称是_____.
(2)将足量稀盐酸加入溶液C中,反应的化学方程式为_____(任写一个).
(3)在蒸发操作中,用玻璃棒搅拌的作用是_____.
(4)如果称量Ⅰ中称得粗盐的质量为5g,称量Ⅱ中称得精盐的质量为5.1g,则下列分析正确的是_____.
A 精盐的产率一定为98.04%
B 精盐的产率一定为102%
C 蒸发操作中可能有水分没有蒸干
D 溶解操作中可能有粗盐没有溶解
E 除杂过程中有NaCl生成
(5)农业生产常用溶质的质量分数为10%~20%的氯化钠溶液来选种.现将100g5%的氯化钠溶液变成质量分数为20%的氯化钠溶液,需要再加氯化钠的质量是_____g.
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是实验室常用的装置,请回答有关问题:
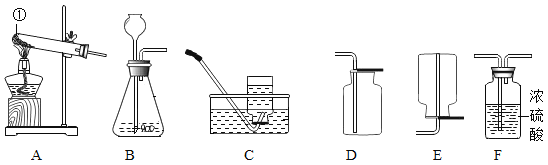
(l)写出图中标号仪器的名称:①_____.
(2)实验室用装置A与C连接制取并收集氧气,则装置A中反应的化学方程式为_____;若用过氧化氢溶液和二氧化锰制取并收集干燥的氧气,应选择装置的连接顺序是_____(填字母).
(3)实验室制取CO2反应的化学方程式为:_____,选用的收集装置是_____(填字母).
查看答案和解析>>
科目: 来源: 题型:
【题目】(8分)A—I是初中化学中常见的物质。它们之间有如下图所示的转化关系。已知A为铝土矿的主要成分,通常情况下F是一种液体,C、D、H、I为气体,H能参与绿色植物的光合作用,G为黑色固体。
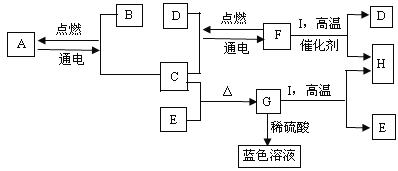
请回答下列问题:
(1)G的化学式是 。
(2)H + 单质碳→I,其反应条件是 。
(3)A ![]() B + C的化学方程式是 。
B + C的化学方程式是 。
(4)I + F(气体)![]() H+D的化学方程式是 。
H+D的化学方程式是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】为了除去铜粉中混有的铁粉,并用提纯的铜粉制取胆矾(CuSO45H2O),某课外活动小组的同学按如下流程进行实验:(反应中部分生成物已略去)

已知:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。
回答下列有关问题:
(1)操作a的名称是 ;除去铜粉中的铁粉,最简便的实验方法是 。
(2)FeCl2溶液中通入Cl2发生化合反应,写出该反应的化学方程式 。
(3)由Cu制CuSO4溶液的途径Ⅱ中,若不通入O2,反应将不会发生,原因是 。途径Ⅱ与途径Ⅰ相比较,其显著的优点是 (回答一点即可)。
(4)FeCl3溶液可腐蚀铜以制作印刷线路板,反应后只生成两种常见的盐,则该反应的化学方程式 为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】节约能源、保护环境、低碳生活是全社会应该倡导的生活方式.
(l)下列物质都可以用来作为燃料:①煤;②氢气:③石油;④天然气.其中,最清洁的燃料是_____(填序号).
(2)充分燃烧1000g天然气和煤所产生的CO2和SO2气体的质量如图所示,根据图示分析,下列说法正确的是_____.
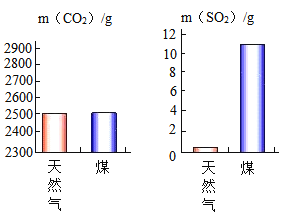
A 煤燃烧产生的气体更易导致酸雨 B 该天然气中不含硫元素
C 煤燃烧对环境影响较小 D 煤和天然气的燃烧都有温室气体产生
(3)硫酸型酸雨的形成主要经过以下两步:①SO2在空气中被粉尘催化氧化得到SO3;②SO3与水化合形成硫酸.其中反应①、②的化学方程式为_____、_____.
(4)某火力发电厂为了防止环境污染,需将废气中的二氧化硫进行处理,其发生的主要反应为2CaCO3+2SO2+O2=2CaSO4+CO2,若100g废气中含有3.2g二氧化硫,则处理500g这种废气需含碳酸钙80%的石灰石_____g.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com