
科目: 来源: 题型:
【题目】“瓦罐浸来蟾有影,金刀剖破玉无瑕”。豆腐是营养丰富、历史悠久的中国美食。
(1)制作豆腐过程的流程如下:
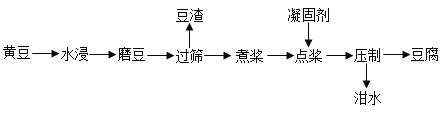

①豆腐制作过程中,利用过滤原理的是_________;(选填以上一种操作)
②“煮浆”时常用废木材作燃料,通常将废木材加工成废木屑,其原因是_________;
③“点浆”即在豆浆中加入某种盐,使溶解在水中的蛋白质溶解度变小而析出。加入的盐可能是___(填字母序号);
a BaCl2 b CuSO4 c MgCl2
④下列扬州美食中,蛋白质含量最丰富的是____(填字母序号);

⑤豆腐与菠菜一般不能同食,因为豆腐中含有一种钙盐(CaSO4),菠菜中含有草酸(H2C2O4),两者会反应,生成草酸钙沉淀(CaC2O4),该反应的方程式为_______________。
(2)豆腐中含有人们生活所需的各类营养素,每100克豆腐中含各种营养成分如下表:
成分 | X | 蛋白质 | 油脂 | 糖类 | 钙 | 磷 | 铁 | 维生素B1 | 维生素B2 |
质量分数/% | 89.3 | 4.7 | 1.3 | 2.8 | 0.24 | 0.064 | 1.4 | 0.00006 | 0.00003 |
①表中X代表六大营养素中的_________________;
②摄入______________(填元素符号,下同)元素不足,易得佝偻病。钙、磷、铁元素中属于人体必需微量元素的是________________;
③蛋白质、油脂和葡萄糖中属于高分子化合物的是__________;
④某成年人若食用了500g豆腐,相当于补充了___________mg的维生素B1。
查看答案和解析>>
科目: 来源: 题型:
【题目】资源利用与社会可持续发展密切相关。
(1)水是一种生活中不可缺少的物质。
①下列能溶于水形成溶液的是_______(填字母序号,下同),所得溶液pH>7的是______;
a 纯碱 b 蔗糖 c 面粉 d 食用油
②生活中可以采用____________方法降低水的硬度;
(2)煤的气化和液化是实现能源清洁化的重要途径。水煤气中H2和CO在加热、加压和催化剂条件下可以合成液体燃料甲醇(CH3OH),该反应中H2和CO的质量比为___________。水煤气(H2和CO)在不同催化剂的作用下,还可以合成其他物质。仅以其为原料不可能化合得到的物质是__________ (填字母序号);
a 草酸(H2C2O4) b 乙酸(C2H4O2) c 尿素[CO(NH2)2]
(3)金属钯是稀有的贵重金属之一。现有银(Ag)、铂(Pt)、钯(Pd)三种金属制成的戒指,某实验小组利用它们来探究三种金属的活动性。
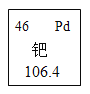
①在元素周期表中,钯元素的信息如图所示,对图中信息解释不正确的是__________;
a 原子序数为46 b 质子数为46 c 相对原子质量为46
②把钯戒指放入稀硫酸中,戒指完好无损,可推测钯在金属活动性顺序表中位于铁之________(填“前”或“后”);
③如图所示,将银、铂戒指分别放入甲、乙两试管溶液中,一段时间后取出,发现只有银戒指表面有明显变化。通过该实验判断,银、铂、钯的金属活动性由强到弱顺序为______________(用元素符号表示);

④将钯粉置于盐酸中,边通入氧气边搅拌,钯粉溶解得到二氯化钯(PdCl2)溶液,该反应的化学方程式为_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某校化学研究性学习小组的同学为了探究氨气与氧化铜反应的产物,设计了如下实验装置图:
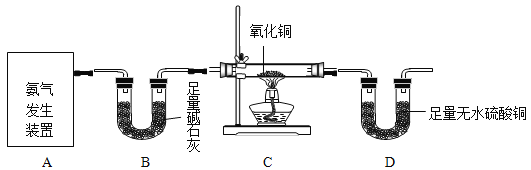
已知:①碱石灰主要成分为氢氧化钠和氧化钙的混合物
②无水硫酸铜遇水变蓝色
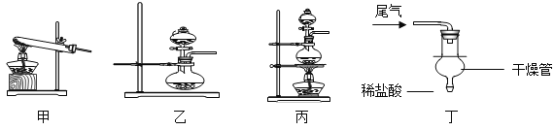
(1)实验室常用加热氯化铵和氢氧化钙的固体混合物来制取氨气,该反应的化学方程式为_________。实验室还可通过向生石灰中滴加浓氨水的方法快速制取少量氨气,则可选择______________(填下图装置编号)作发生装置。检验氨气常用湿润的___________石蕊试纸;
(2)实验操作中,应___________(填字母序号);
a 先通氨气,后点燃酒精灯 b 先点燃酒精灯,后通氨气
(3)装置C处现象为________________,则说明可能生成铜;
(4)装置________________(填装置字母序号)和装置D的组合证明有水生成;
(5)实验中还生成了一种气体单质,该小组同学依据____________________,猜想该单质为氮气;
(6)若装置C连同固体质量减轻4.8g,则装置D增加的质量为_____________g。实验测得装置D增加的质量大于理论值,可能的原因是__________________________;
(7)氨气也是污染物,在D装置后可连接丁装置,以吸收尾气中未参加反应的氨气。干燥管的作用是___________(填序号);
①防止氨气逸出 ②防止液体倒吸 ③防止盐酸挥发
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组利用石灰石残渣(杂质不溶于水也不溶于酸)制备轻质CaCO3,同时得到K2SO4,流程如下:
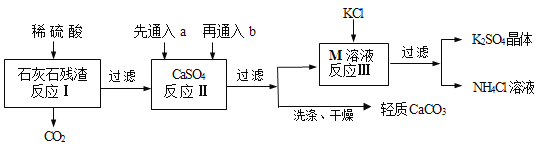
已知:CaCO3+H2O+CO2=Ca(HCO3)2
(1)为了提高反应Ⅰ的速率,下列措施中可行的是____________(填序号);
①搅拌
②将残渣粉碎成细小颗粒
③适当增大硫酸的浓度
(2)反应Ⅱ中a和b分别是_______________(填序号);
①足量CO2、适量NH3 ②足量NH3、适量CO2
③适量CO2、足量NH3 ④适量NH3、足量CO2
(3)反应Ⅲ中相关物质的溶解度如下表,该表中M物质的化学式为___________,反应Ⅲ在常温下能实现的原因是________,生成的NH4Cl溶液在农业上可用作_______________;
物质 | KCl | K2SO4 | NH4Cl | M |
溶解度/g(25℃) | 34.0 | 11.1 | 37.2 | 19.5 |
(4)判断CaCO3固体已洗涤干净的方法:取最后一次洗涤液,______(①滴加稀盐酸、② 滴加Na2SO4 溶液、③ 滴加BaCl2溶液,填写序号),若无明显的现象,则已洗净;
(5)过滤器的制作如图,正确的顺序是______(填序号);
(6)该工艺流程中循环利用的物质除了水,还有_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组提出可以用废锌渣(主要成分是ZnO、FeO、Fe2O3、CuO)进行适当处理可制得硫酸锌晶体(ZnSO4·x H2O)。
Ⅰ、硫酸锌晶体的制备
该兴趣小组同学设计了如下流程:

已知:①硫酸锌晶体难溶于酒精
②硫酸锌晶体受热易逐步失去结晶水
③几种物质沉淀时的pH如下表:
物质 | Fe(OH)3 | Zn(OH)2 | Cu(OH)2 |
开始沉淀时pH | 1.48 | 6.2 | 5.2 |
完全沉淀时pH | 3.2 | 8.0 | 6.4 |
(1)酸浸中生成硫酸锌的化学方程式为___________,属于________(填基本类型)反应。
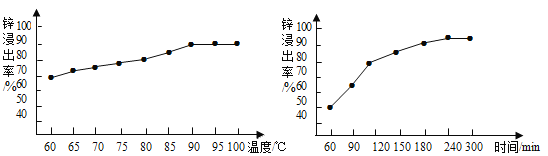
(2)酸浸时温度和时间对锌浸出率的影响见下图。为了提高锌的浸出率,反应的最佳温度是__________℃,最佳时间是____________min;
(3)加H2O2的目的是将酸浸后的Fe2+氧化成Fe3+,其反应方程式为2FeSO4 + H2O2 + _____= Fe2(SO4)3 + 2H2O,KMnO4溶液也能将Fe2+氧化成Fe3+,并生成可溶性的锰盐,选择H2O2的优点是_________;
(4)加入ZnO调节溶液的pH约为4的目的是__________;
(5)流程中,滤渣Y的成分为_________________;
(6)流程中“一系列操作”主要过程为:①_________________ 、冷却结晶、过滤,加入酒精洗涤,重复几次,最后低温烘干,得到ZnSO4·xH2O;
②用酒精洗涤的目的是洗去晶体表面的杂质、避免因水洗涤所造成的晶体损耗、_________;
③低温烘干的原因是_______________。
Ⅱ、硫酸锌晶体(ZnSO4·xH2O)组成的测定
学习小组取5.74g硫酸锌晶体(ZnSO4·xH2O)进行加热分解,获得相关数据,并绘制成剩余固体质量一温度的关系图。
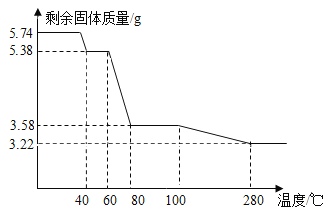
(7)280℃时,固体完全失去结晶水。根据图中数据,计算ZnSO4·xH2O中x的值为_____________;(请写出计算过程)
(8)加热过程中,硫酸锌晶体分步失去结晶水。请写出60℃到80℃时反应方程式_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铜及其化合物在生产、生活中都有广泛的应用。
兔首和鼠首均为青铜器(铜、锡合金),表面呈绿色,这是铜器长期暴露在空气中生成了铜锈(铜锈俗称铜绿)。铜绿化学式是Cu2(OH)2CO3,它受热会分解生成三种氧化物。
(1)青铜器属于_____(填“金属材料”或“合成材料”)。
(2)铜绿中铜元素的化合价为_____,铜绿受热分解反应的化学方程式为_____。
(3)为了弄清铜生成铜绿的条件,某化学实验小组借鉴课本“铁钉锈蚀条件的探究”实验,设计了“铜片锈蚀条件的探究”实验,实验如下图所示(所用铜片洁净、光亮,试管内的“![]() ”为铜片)。
”为铜片)。
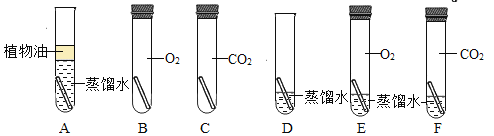
实验较长时间后,发现_____(填试管编号)试管中铜片最先生锈。小组讨论后发现实验还不够完善,要得出正确的结论,还要补充一个实验。你认为要补充的一个实验是:Cu和_____(写出试管中需要的物质)。可以省略不做的实验是试管_____(填试管编号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是实验室常用的气体发生装置和收集装置。请回答下列问题:
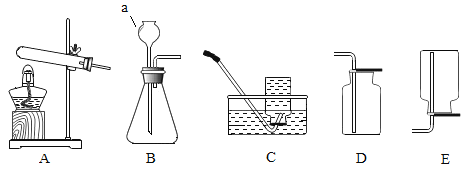
(1)写出图中有标号a仪器的名称:_____。
(2)实验室用过氧化氢和二氧化锰制取并收集一瓶较纯净的氧气,应选择制取气体的发生装置和收集装置是_____(填字母序号),反应的化学方程式是_____。
(3)实验室制取二氧化碳反应的化学方程式为_____。以下是某同学实验时的主要操作步骤,这些操作步骤的正确顺序是_____(填字母序号)。
A 向仪器中装入药品 B 清洗仪器,整理实验台 C 检査装置的气密性 D 收集气体
查看答案和解析>>
科目: 来源: 题型:
【题目】A~G都是初中化学中常见物质,其中B、D是无色气体,C为白色沉淀,A、E、F是黑色固体,G为红色固体,C为白色沉淀。这些物质之间的转化关系如下图所示(部分反应物和生成物略去)。
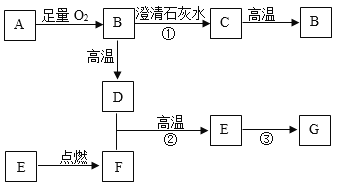
(1)写出A的化学式:_____。
(2)写出C的一种用途:_____。
(3)物质F属于_____(填“酸”、“碱”、“盐”、或“氧化物”)。
(4)写出③反应的化学方程式:_____,该反应的基本反应类型是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】质量守恒定律的发现对化学的发展做出了巨大贡献。
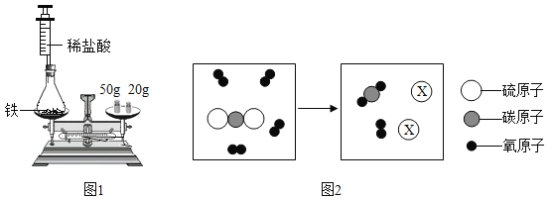
(1)为验证质量守恒定律,小华设计如图1所示装置进行实验。实验时,先将装有药品的装置放在天平上,添加砝码,移动游码至天平平衡(如图1所示),然后取下装置,用针筒向锥形瓶中注入少量稀盐酸,反应结束后再将装置放置于天平上,观察到_____,从而验证了质量守恒定律。若只将锥形瓶改为烧杯,则不能验证质量守恒定律,原因是_____。
(2)某反应的微观示意图如图2所示。
①X的化学式是_____。
②根据上述微观示意图,可得出反应前后改变的是_____(填具体微粒名称)。
查看答案和解析>>
科目: 来源: 题型:
【题目】a.枇杷果实中富含果糖、多种维生素、钙、铁等营养成分。
(1)枇杷中“钙、铁”指的是_____(填“原子”、“分子”或“元素”),青少年缺_____元素会引起佝偻病。
(2)枇杷中含有可以为人体提供主要能量的_____(填一种营养素名称)。
(3)果糖(C6H12O6)中碳元素的质量分数是_____。
(4)合理施用化肥可以使枇杷增收。请写出一种复合肥料_____(填化学式)。
b.“共享单车”是指在公开场所提供共享服务的自行车,由于符合“低碳出行”的理念,颇受年轻人的喜爱。
(5)“共享单车”车架的表面喷漆不仅美观,而且可有效阻止铁与_____接触而锈蚀。
(6)自行车的有些部件是由钢铁制成的,写出炼铁中一氧化碳与氧化铁反应的化学方程式为_____。
(7)扫描二维码可以租用“共享单车”,二维码的制作材料一般是用PVC不干胶贴纸。PVC[化学式(C2H3Cl)n]中碳元素和氢元素的质量比为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com