
科目: 来源: 题型:
【题目】“宏观辨识与微观探析”是化学核心素养之一。工业上用甲和乙两种物质在一定条件下反应生成丙和丁,参加反应的甲和乙及生成丙的分子个数比为4:3:6,反应的微观示意图如下所示。下列说法正确的是( )
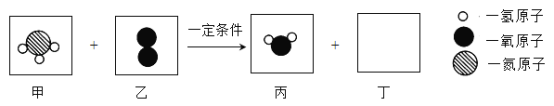
A. 甲中氮元素和氢元素的质量比为1:3
B. 每个丁分子中共含有4个原子
C. 该反应不属于基本反应类型
D. 生成的丙和丁的分子个数比为3:1
查看答案和解析>>
科目: 来源: 题型:
【题目】“化学链燃烧”技术是目前能源领域研究的热点之一。氧化镍(NiO)作载氧体的“化学链燃烧”过程如图所示:

相比直接燃烧甲烷,对该技术的评价错误的是( )
A. 能量损耗少、利用率高
B. 较安全,减少爆炸风险
C. 消耗等质量甲烷,参加反应氧气较少
D. 有利于分离和回收较纯净的二氧化碳
查看答案和解析>>
科目: 来源: 题型:
【题目】 如图为金刚、石墨和C60的结构模型图,图中小球代表碳原子。下列说法不正确的是( )
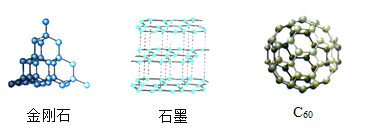
A. 原子的排列方式改变,则构成的物质种类改变
B. 相同元素组成的不同物质,在足量的氧气中完全燃烧,产物相同
C. 相同元素组成的不同物质,化学性质相同
D. 在特定的条件下,石墨既可转化为金刚石,也可转化为C60
查看答案和解析>>
科目: 来源: 题型:
【题目】我国拥有自主知识产权的硅衬底高光效氮化镓发光二极管(简称LED)技术,已广泛用于照明、显像等多个领域。氮和镓的原子结构示意图及镓在元素周期表中的信息如下图所示,下列说法正确的是( )

A. 镓元素位于第三周期,属于金属元素B. 镓原子核内有31个中子
C. 镓的相对原子质量是69.72gD. 氮化镓的化学式为GaN
查看答案和解析>>
科目: 来源: 题型:
【题目】用如图装置探究分子运动,以下说法错误的是( )
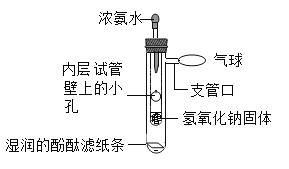
A.该实验说明分子在不断运动
B.氢氧化钠吸水放热,加速浓氨水的挥发
C.该实验通过酚酞溶液变红可证明氢氧化钠呈碱性
D.该装置的优点:现象迅速出现、药品用量少、环保无污染
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组的同学取氢氧化钠和碳酸钠的混合溶液50g装入烧杯中,每次滴加50g稀盐酸充分反应。测得部分数据及图像如下:
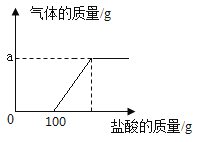
次数 | 1 | 2 | 3 | 4 | 5 |
加入稀盐酸的质量/g | 50 | 50 | 50 | 50 | 50 |
烧杯中物质的质量/g | 100 | 150 | 197.8 | 245.6 | 295.6 |
请根据有关信息计算:
(1)a的数值为________。
(2)稀盐酸中溶质的质量分数为_____。(写出计算过程)
(3)恰好完全反应后所得溶液中溶质的质量为_____。(写出计算过程)
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组的同学,通过咨询老师准备用亚硫酸钠溶液与浓硫酸反应来制备一定量的![]() ]。老师给他们提供了一瓶亚硫酸钠溶液并告知该瓶溶液放置时间可能较长,不知是否变质。兴趣小组的同学分成甲、乙两小组对该瓶亚硫酸钠溶液成分进行实验探究。
]。老师给他们提供了一瓶亚硫酸钠溶液并告知该瓶溶液放置时间可能较长,不知是否变质。兴趣小组的同学分成甲、乙两小组对该瓶亚硫酸钠溶液成分进行实验探究。
[提出问题]该瓶溶液中溶质的成分是什么?该瓶溶液中亚硫酸钠的质量分数是多少?
[查阅资料]
a、Na2SO3有较强还原性,在空气中易被氧气氧化:![]() ;
;
b、Na2SO3能与酸反应产生SO2气体;
c、SO32-、SO42-均能与Ba2+反应产生白色沉淀,BaSO3可溶于稀盐酸。
[作出猜想]
猜想1:没有变质,成分是Na2SO3;
猜想2:完全变质,成分是Na2SO4;
猜想3:部分变质,成分是Na2SO3和Na2SO4。
[实验探究I]甲组设计实验探究溶液是否变质:
甲组 | 实验操作 | 现象 | 结论 |
步骤1 | 取少量样品于试管中加入过量稀盐酸。 | 产生气泡 | 溶液中含有_____ |
步骤2 | _____ | _____ | 溶液中含有Na2SO4 |
实验结论是_____。
[实验探究Ⅱ]乙组设计如下实验测定Na2SO3溶液的溶质质量分数。
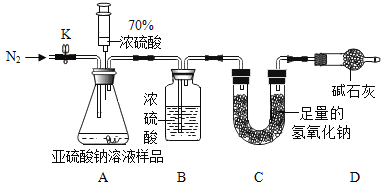
(1)连好装置并检查装置气密性,在锥形瓶中放人126g该样品,通入N2的目的是_____。
(2)实验前称量C装置的质量为128.8g。
(3)关闭活塞K,用注射器推入浓硫酸至不再产生气泡,注射器可以换为_____,也能控制液体试剂的滴加速率。
(4)打开活塞K,缓缓鼓入一定量的N2,继续通入N2的作用是_____。
(5)再次称量C装置的质量为135.2g。
(6)计算出该溶液中Na2SO3的质量分数为10%,若没有D装置,实验结果将_____(填“偏大”“不变”或“偏小”)。
[反思]由此可得出,保存亚硫酸钠时应_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上利用某废渣(含FeSO4、Fe2(SO4)3及少量CaO和MgO)制备高档颜料铁红(主要成分为Fe2O3)和回收(NH4)2SO4,其生产流程如下:
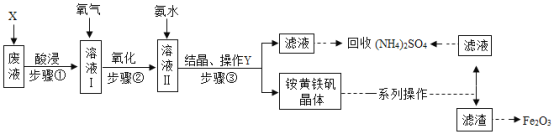
已知:a、氧化还原反应中,会有元素化合价发生变化。
b、![]() 回答下列问题:
回答下列问题:
(1)(NH4)2Fe6(SO4)4(OH)12中铁元素的化合价是_____。
(2)粉碎废渣的目的_____,加入物质X溶解废渣,X应选用_____(填序号)。
A 盐酸
B 硫酸
C 氨水
D 氢氧化钠
步骤①酸浸时,生成盐的化学方程式为_____(任写一个)。
(3)步骤③中操作Y的名称是____,滤液中除含有很少量铵黄铁矾外还含有__。
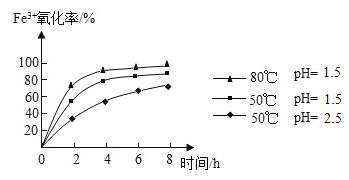
(4)步骤②通入氧气氧化的目的是_____,工业上对该操作控制在4小时左右为宜,根据如图有关数据分析,影响Fe3+氧化率的变化规律:_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验员王老师要配制80g质量分数为10%的NaOH溶液供同学们使用,如图表示了他的实验操作过程。
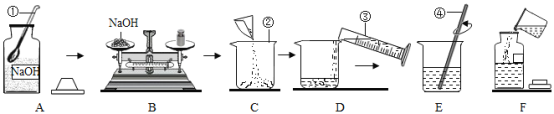
回答下列问题:
(1)写出仪器的名称①_____②_____
(2)B操作中有一处错误是_____,应称NaOH的质量是_____g,称量过程中若指针偏左,应进行的操作是_____。
(3)仪器③的规格应是_____(选填“50mL”或“100mL”),量取水时除仪器③外,还需要的一种仪器是_____。
(4)E操作中④的作用是_____。
(5)下列错误操作可能导致溶质的质量分数偏小的是_____(填序号)。
①B操作中砝码与NaOH放颠倒了(1g以下用游码)
②C操作中使用的烧杯内壁有水
③用量筒量水时仰视凹液面最低处读数
④F操作中溶液洒落
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com